01不应联用?唑来膦酸盐+新辅助化疗乳腺癌OS变差
双膦酸盐类药物能治疗和预防骨质疏松并预防肿瘤骨转移,目前已经作为绝经后和接受卵巢抑制治疗的乳腺癌患者辅助治疗。不过,其背后的具体机制还没有定论,双膦酸盐联合新辅助化疗对患者的影响也还存在一些争论,最近来自NEOZOTAC研究的结果认为,唑来膦酸盐(zoledronic acid, ZA)与新辅助化疗联用可能会使乳腺癌患者的OS变差。研究发表在《Breast Cancer Resserch》。
图 1 研究共纳入了264名患者
这一研究共纳入了264名HER2阴性、II/III期乳腺癌患者,其中39.4%为绝经后患者随机接受标准的6周期新辅助化疗±4mg ZA,每21天重复一次,共重复6个周期。同时还测定了这些患者胰岛素、血糖、胰岛素生长因子-1(IGF-1)和IGF-1受体(IGF-1R)的表达水平。中位随访6.4年,先前发表的研究结果显示,联合ZA的新辅助化疗并不能改善患者的病理学完全缓解(pCR),获得pCR的患者比例为13.3%。
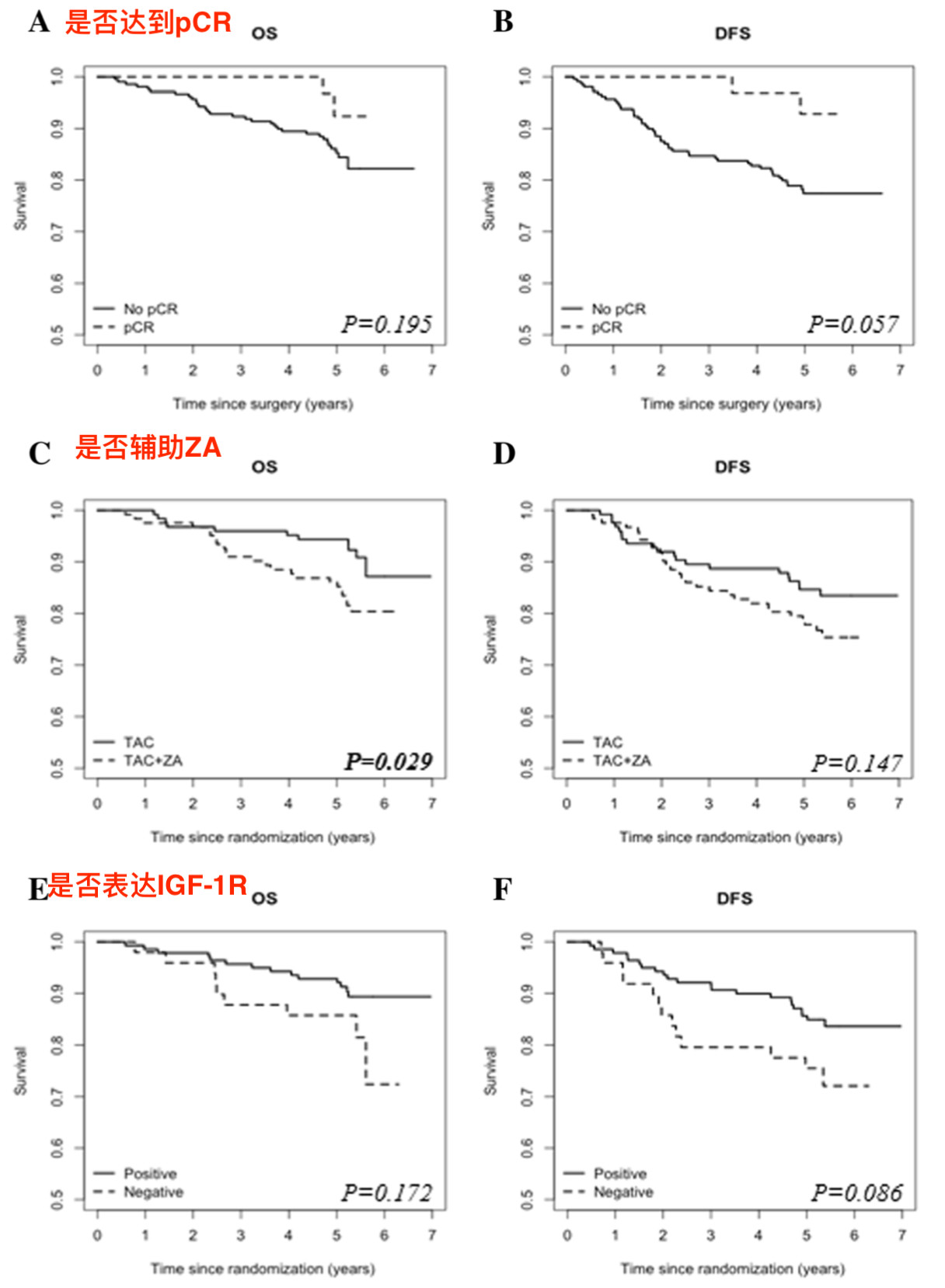
图 2 ZA辅助治疗并未改善患者的OS/DFS
此次进一步报道了其他次要终点结果,发现与未接受ZA治疗的患者相比,联合使用ZA患者的OS反而更差(HR 0.468, 95%CI 0.226-0.967; p=0.040),但无病生存(DFS)在两组之间没有显著差异(0.656 ,0.371-1.160; p=0.147)。亚组分析结果显示,在绝经后妇女中,联合使用ZA患者的OS和DFS与对照组相比均没有显著差异(p=0.120; p=0.159);在绝经前妇女中,联合使用ZA患者的OS和DFS与对照组相比同样没有显著差异(p=0.565; p=0.152)。此外,新辅助治疗前后肿瘤组织中IGF-1R的表达不能预测生存率,但较低的血清胰岛素水平与DFS改善相关(p=0.014)。
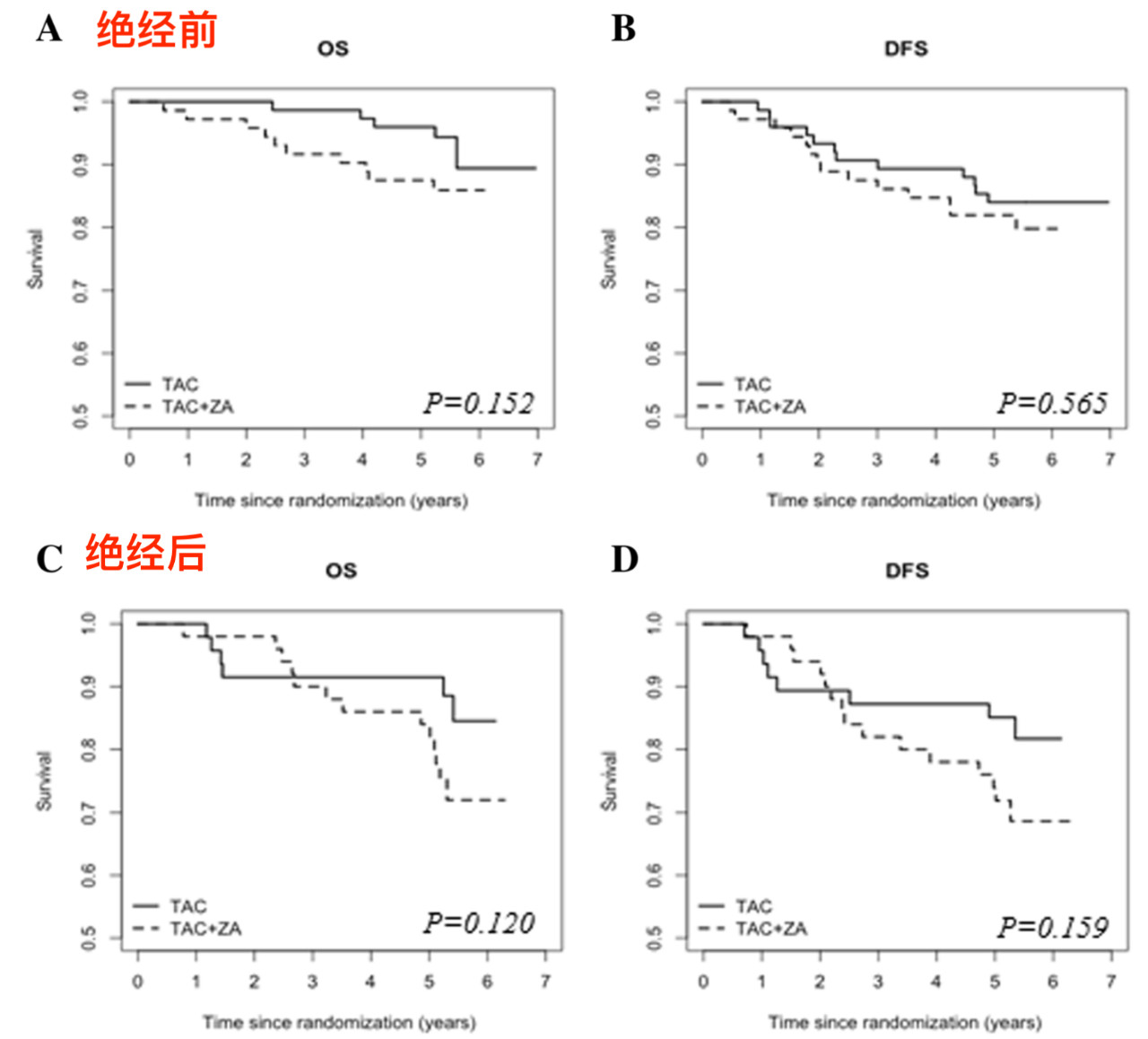
图 3 绝经前/后ZA辅助治疗与OS/DFS均无关系
研究人员指出,之前的研究显示ZA能为绝经后乳腺癌患者带来益处,但此次研究的结果真的让他们大跌眼镜。他们认为,此次研究之所以得出“有害”的结果,可能是由于纳入的患者大多数是绝经前的患者。不过,他们也承认在绝经后妇女中的分析也没有得出“有益”的结果。此次研究主要的意义可能在于再次证明了胰岛素和IGF-1R途径在乳腺癌生长中的重要性,但研究人员不得不承认他们的结果不支持ZA联合乳腺癌患者新辅助化疗。
02谨慎选择!乳房切除术保留乳头复发风险需要评估
乳腺癌的治疗中,除了单纯切除乳房的手术之外,还可以选择保留乳头的乳房切除术(NSM),尽管去除了乳房组织,但保留整个乳头-乳晕复合体(NAC)和乳房周围的皮肤,为后续的乳房重建提供了更多可能,更能改善患者的生活质量。不过,最近来自韩国的研究者指出,这一术式可能会增加局部癌症复发的风险,在选择时需要更为审慎的评估。研究发表在《JAMA Surgery》。

图 4 NSM术中冰冻切片检查
这项研究共纳入了944名浸润性乳腺癌患者,诊断时的平均年龄为43岁,共涉及962个乳房。患者在接受NSM术后立即进行了乳房重建,其中498名接受了辅助化疗,750名接受了辅助内分泌治疗,97名接受了辅助放疗,中位随访时间为85个月,39名患者出现了术后复发,5年累积癌症复发率为3.5%。 分析发现,与复发风险增加独立相关的因素包括,多灶性或多中心乳腺癌(HR 3.309, 95%CI 1.501-7.294; p=0.003)、激素受体阴性/HER2阳性(3.051, 1.194-7.796; p=0.02)、较高的组织学分级(2.641, 1.132-6.160; p=0.03)和广泛导管内成分阳性(3.338, 1.262-8.824; p=0.02)的患者复发风险更高。换言之,这些患者在选择这一手术时候应该谨慎。 所幸39名复发病例均在发现之后接受了广泛的局部切除术,是否出现NAC周围的复发对于患者的无远处转移生存(p=0.95)或总生存(p=0.21)没有显著的影响,术后有无复发患者的10年无远处转移生存率分别为89.3%和94.3%,10年总生存率为分别为100.0%和94.5%。
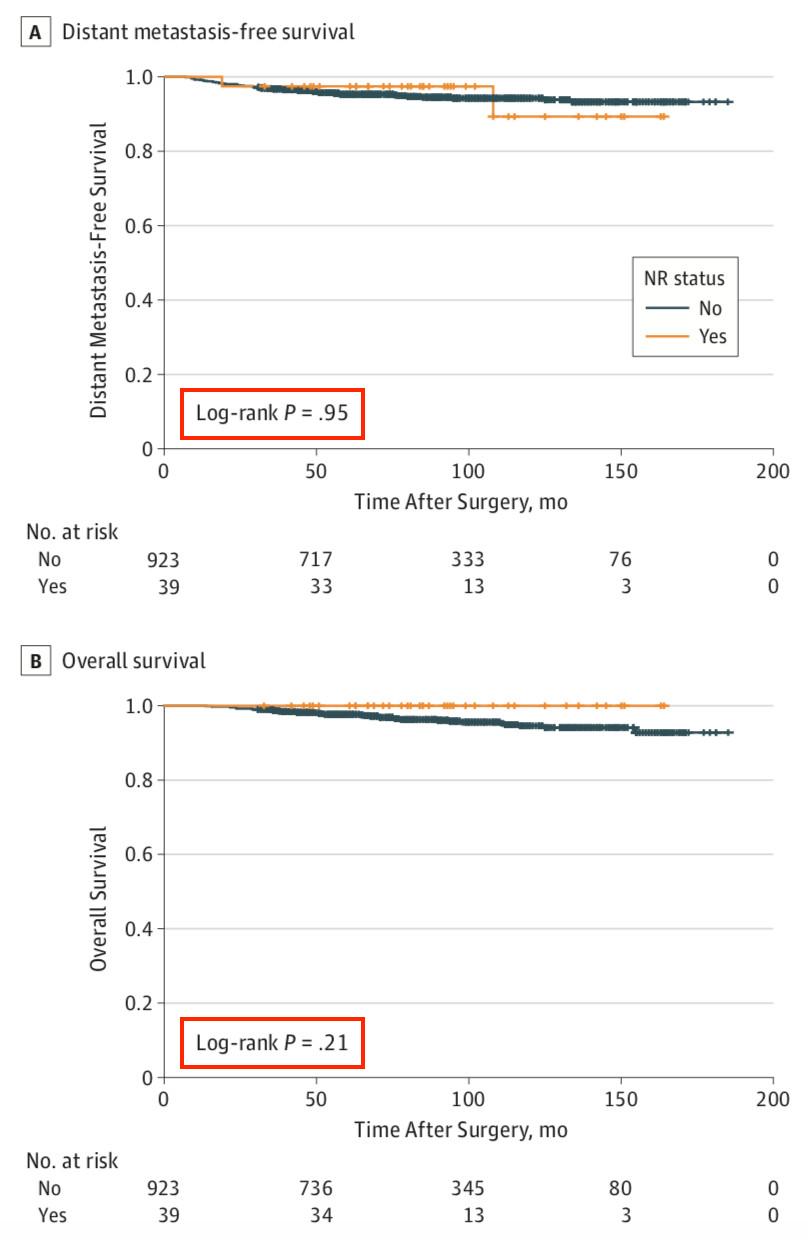
图 5 NSM术后复发不影响患者预后
研究人员指出,具有复发高危因素的患者,在选择NSM手术的时候应该更为谨慎,谨防NAC附近的残留肿瘤组织导致乳腺癌的局部复发,指南传统上一般也仅建议NAC受累风险较低的患者选择这一术式。研究中是否采用NSM手术主要取决于肿瘤大小和肿瘤-乳晕距离,此外术中冷冻切片检查也被用于确定隐匿性的乳头受累。最后,研究人员则指出,大多数NAC癌症复发患者在接受适当的综合治疗后预后依然良好,随着越来越多的乳腺癌患者接受NSM,NAC癌症复发的预测和决策会得到更多的数据支持。
03 双管齐下!mTORC1/2抑制剂改善乳腺癌患者PFS
激素受体阳性的晚期/转移性乳腺癌患者的内分泌治疗耐药可以通过使用PI3K-mTOR抑制剂来克服,然而仅使用一种mTOR1抑制剂并不能完全抑制肿瘤对内分泌治疗的抵抗。因此,最近的研究就比较了依维莫司(Everolimus)、氟维司群(Fulvestrant)、Vistusertib等mTOR抑制剂联合应用对患者的疗效,发现依维莫司+氟维司群能够延长患者的PFS。研究发表在《JAMA Oncology》。
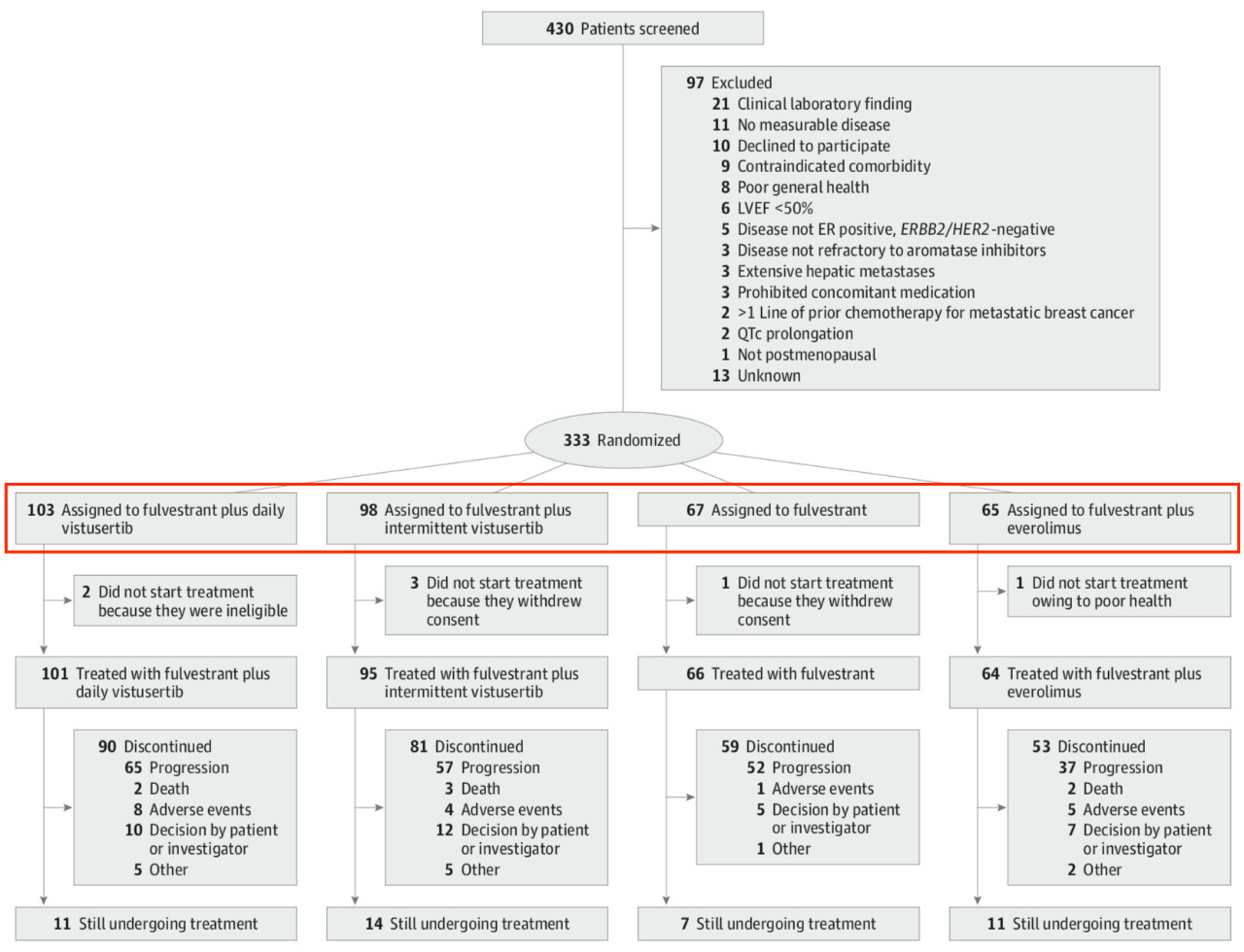
图 6 研究共设置了4个治疗组
这项2期临床MANTA研究共纳入了来自9个国家的333名平均年龄为63岁的雌激素受体阳性的乳腺癌患者,均在接受芳香酶抑制剂治疗之后进展,出现了对内分泌治疗的耐药。在研究中,67名患者接受单独的氟维司群治疗、103名患者接受氟维司群+每日Vistusertib治疗、98名患者接受氟维司群+间歇Vistusertib治疗、65名患者接受氟维司群+依维莫司治疗。表 1 氟维司群+依维莫司组的PFS最长
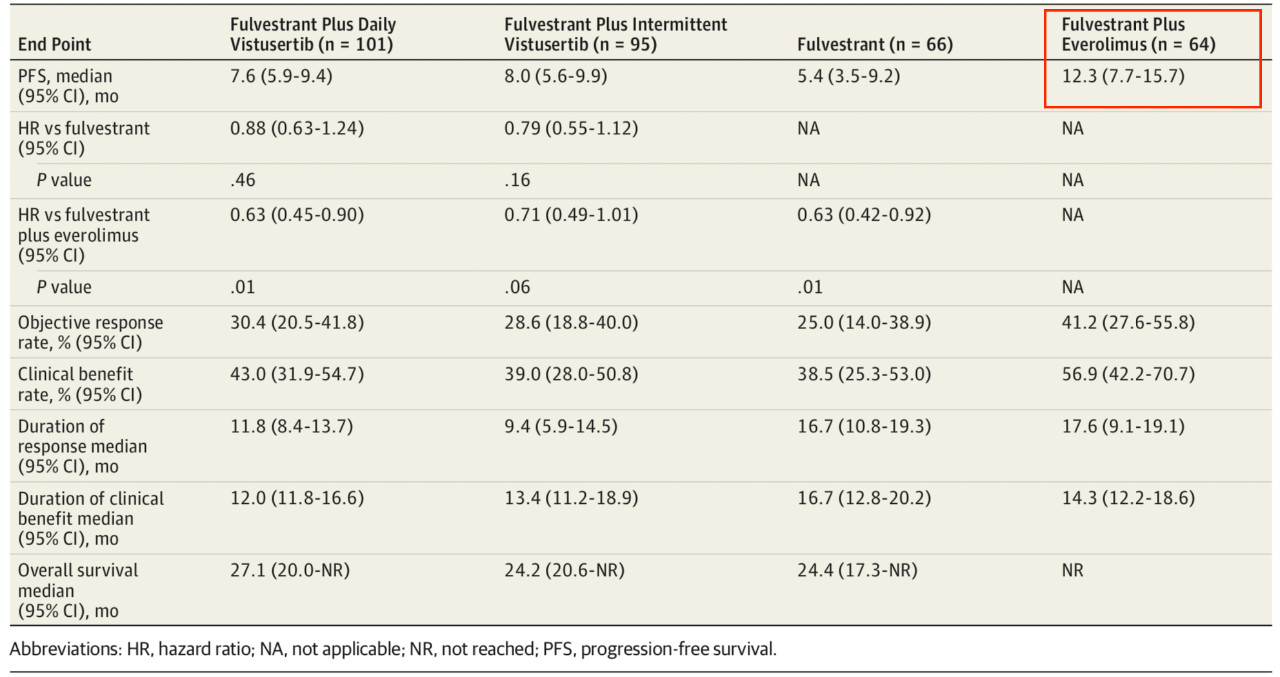
结果发现,单独的氟维司组的PFS为5.4个月(95%CI 3.5-9.2个月),氟维司群+每日Vistusertib组的PFS为7.6个月(5.9-9.4个月),氟维司群+间歇Vistusertib组的PFS为8.0个月(5.6-9.9个月),氟维司群+依维莫司组的PFS表现最为出色,为12.3个月(7.7-15.7个月)。各个治疗组之间比较的结果显示,氟维司群+每日/间歇Vistusertib组和单独的氟维司组患者的PFS无显著差异(HR 0.88, 95%CI 0.63-1.24, p=0.46; 0.79, 0.55-1.12, p=0.16)。而氟维司群+依维莫司组的PFS则明显比氟维司群+每日/间歇Vistusertib组和单独的氟维司组更长。
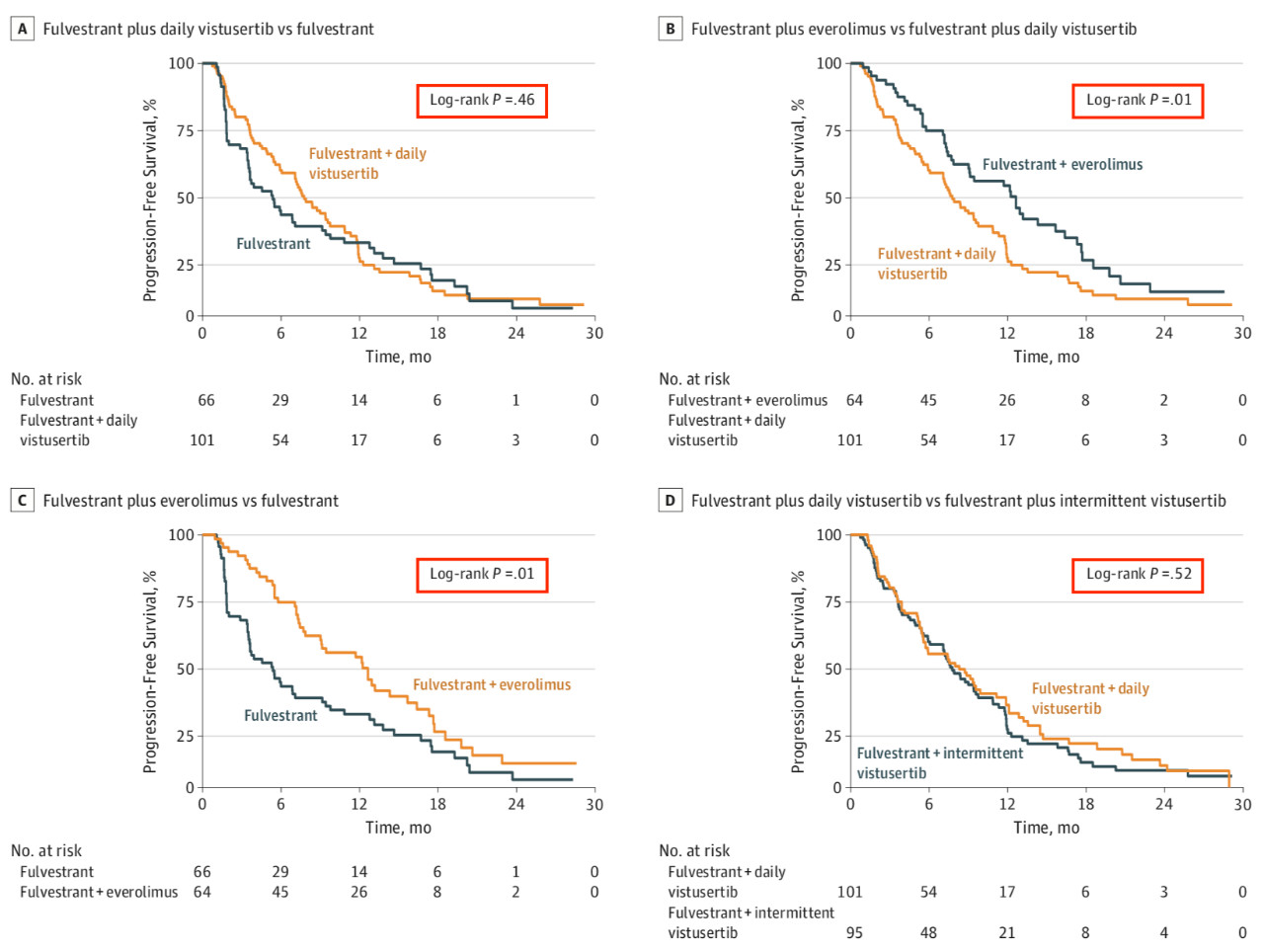
图 8 氟维司群+Vistusertib的疗效不如氟维司群+依维莫司 研究的结果提示,双重mTOR抑制的疗效不如依维莫司对mTORC1的抑制作用。这可能是同时抑制mTORC2导致完全抑制mTORC通路的治疗效果和毒性作用两相平衡的结果,研究不支持在雌激素阳性的乳腺癌患者中进一步评估Vistusertib治疗的作用。不过,正如评论所指出的,这一研究提出了新的问题:在肿瘤治疗中进行mTORC1/2的双重抑制和治疗是否在临床上可行以及这一治疗是否优于单独的mTORC1抑制。
参考文献
[1] de Groot S, Pijl H, Charehbili A, et al. Addition of zoledronic acid to neoadjuvant chemotherapy is not beneficial in patients with HER2-negative stage II/III breast cancer: 5-year survival analysis of the NEOZOTAC trial (BOOG 2010-01). Breast Cancer Res. 2019 Aug 28;21(1):97. doi: 10.1186/s13058-019-1180-6.
[2] Wu ZY, Kim HJ, Lee JW, et al. Breast Cancer Recurrence in the Nipple-Areola Complex After Nipple-Sparing Mastectomy With Immediate Breast Reconstruction for Invasive Breast Cancer. JAMA Surg. 2019 Aug 28. doi: 10.1001/jamasurg.2019.2959.
[3] Schmid P, Zaiss M, Harper-Wynne C, et al. Fulvestrant Plus Vistusertib vs Fulvestrant Plus Everolimus vs Fulvestrant Alone for Women With Hormone Receptor-Positive Metastatic Breast Cancer: The MANTA Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019 Aug 29. doi: 10.1001/jamaoncol.2019.2526.
[4] Unni N, Arteaga CL. Is Dual mTORC1 and mTORC2 Therapeutic Blockade Clinically Feasible in Cancer? JAMA Oncol. 2019 Aug 29. doi: 10.1001/jamaoncol.2019.2525.