01摄入煎炸油会使结肠癌和结肠炎恶化
尽管煎炸食品在全世界都很受欢迎,但是目前关于煎炸油摄入对人体健康的影响尚无定论,相关饮食建议或指南也未确立。 美国麻省大学阿默斯特分校食品学科学家首次用动物模型研究了煎炸油摄入对炎症性肠病(IBD)和结肠癌的影响,发现添加煎炸油的饮食可使小鼠的IBD和IBD相关性结肠肿瘤发生进展,且这些结果可能由煎炸油中的极性化合物(含有高浓度脂质过氧化物)所介导[1,2]。研究结果近日发表于《Cancer Prevention Research》。主要研究者Jianan Zhang博士、Guodong Zhang副教授和Eric Decker教授表示,给小鼠喂食煎炸油会增强结肠炎症反应,促进肿瘤生长,加剧肠漏,使细菌或有毒性的细菌产物播散到血液中。 研究者还表示,他们的核心发现不是“煎炸油可致癌”,而是“添加煎炸油的饮食加剧了小鼠IBD和IBD相关结肠肿瘤进展”。因此,对于患有或易患IBD的人来说,应少吃煎炸食品。
■ 研究细节
该研究使用真实世界中的菜籽油样本,即其从马萨诸塞州阿默斯特一家餐馆收集的标准商用油炸锅烹饪沙拉三明治[每天煎炸6~8次,共约8小时;煎炸油温为325°F(163°C)]一周后的菜籽油。 研究中,在葡聚糖硫酸钠(DSS)诱导的结肠炎和氧化偶氮甲烷(AOM)/DSS诱导的结肠癌小鼠模型中,给予小鼠添加煎炸油和新鲜油的粉末饲料(实验组)或给予只加入新鲜油的粉末饲料(对照组),试图模仿人类的饮食。 研究者分析饮食对结肠炎症、结肠肿瘤生长和肠漏的影响,结果发现煎炸油饮食会使这些病症恶化。具体体现为:实验组结肠促炎细胞因子(Il-1β、IL-6和Mcp-1)表达明显增加(图1D),实验组肿瘤大小几乎是对照组的两倍(图2B)等。
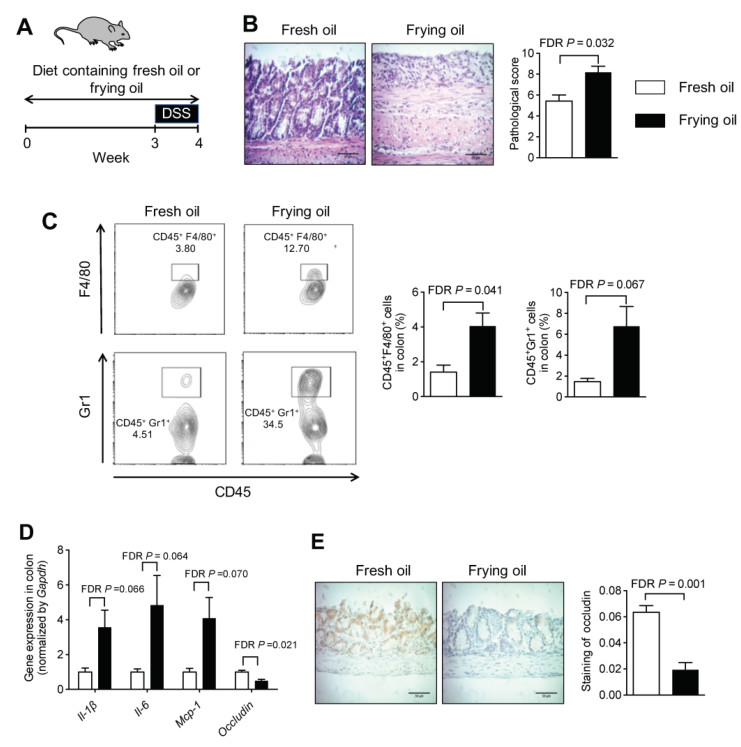
图1添加煎炸油的饮食加重了小鼠的结肠炎
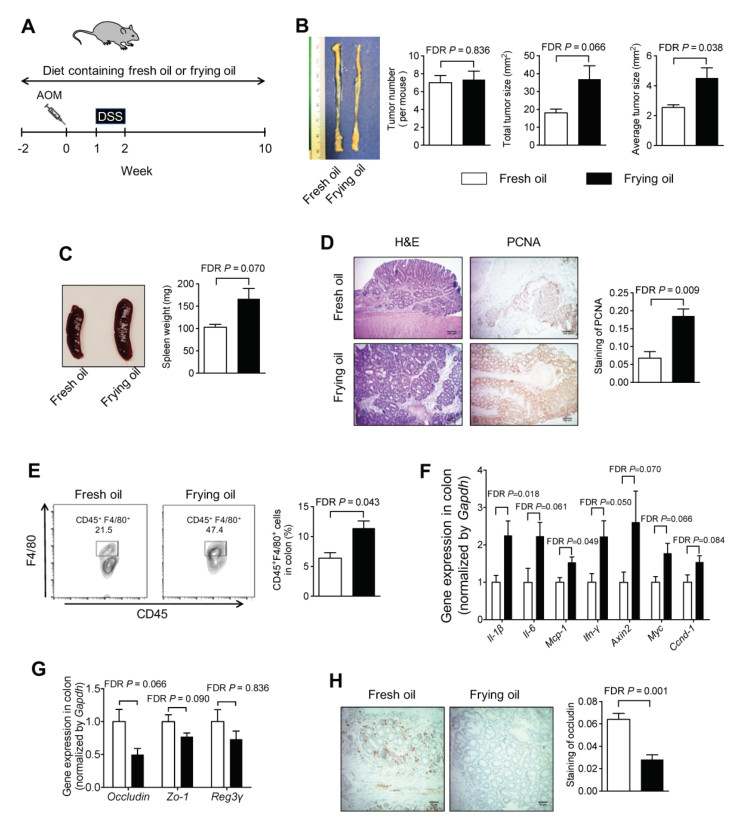
图2 添加煎炸油的饮食加重了小鼠的结肠癌
此外,为了验证假设“油加热时使多不饱和脂肪酸氧化,进而促进炎症反应”,研究者从煎炸油中分离出极性化合物并将其喂给小鼠。结果发现,添加极性化合物的饮食加强了DSS诱导小鼠的结肠炎,这表明极性化合物可能介导了炎症反应。
02磷酸二酯酶5抑制剂或可降低结直肠癌风险
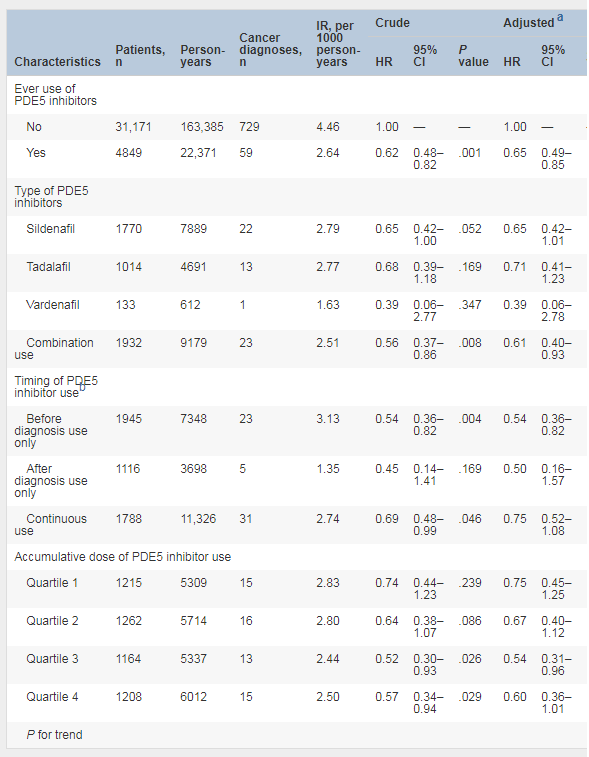
尽管有研究显示,磷酸二酯酶5(PDE5)抑制剂对结直肠癌(CRC)具有化学预防作用,但缺乏基于人群的研究数据。 瑞典隆德大学初级卫生保健研究中心Jianguang Ji等的一项基于人群的研究表明,PDE5抑制剂的使用与男性良性结直肠肿瘤患者的CRC风险降低相关,且该风险降低与PDE5抑制剂累积剂量增加相关[3]。研究结果发表于《Gastroenterology》。■ 研究细节该回顾性队列研究从瑞典医院出院登记处和瑞典处方药登记处,共识别了36,020名于2005年7月至2015年3月期间被诊断为良性结直肠肿瘤的男性,其中包括4849例使用PDE5抑制剂者和31,171例未使用PDE5抑制剂者,旨在探讨使用PDE5抑制剂(包括西地那非,他达拉非和伐地那非)是否与良性结直肠肿瘤男性患者的CRC风险降低相关。 结果显示,在累计22,371人年的随访后,使用PDE5抑制剂患者中有59人被诊断患CRC,发病率为2.64/1000人年,而没有使用PDE5抑制剂患者的CRC发病率则为4.46/1000人年(表1)。 PDE5抑制剂的使用与CRC风险降低之间呈明显的负相关(调整HR 0.65; 95%CI 0.49-0.85); PDE5抑制剂累积剂量增加与CRC风险降低相关(P=0.003)。 由于癌症病例数有限,西地那非、他达拉非或伐地那非的使用与CRC风险之间关联未见明显差异。 表1良性结直肠肿瘤男性使用PDE5抑制剂与结直肠癌风险之间的关联

此外,与结肠癌(调整HR 0.74; 95%CI 0.54-1.02)相比,直肠癌(调整HR 0.46; 95%CI 0.27-0.79)与使用PDE5抑制剂的负相关关联性更强;与I 或 II期CRC(调整HR 0.70; 95%CI 0.50~0.98)相比,III 或 IV期CRC(调整HR 0.61; 95%CI 0.37~1.00)与使用PDE5抑制剂的负相关关联性更强,但均无显著差异。
03增加PD-L1表达或可改善结肠癌化疗效果
程序性死亡配体1(PD-L1)是一种免疫检查点蛋白,其与程序性细胞死亡蛋白1(PD-1)相互作用,可负向调节细胞功能,使肿瘤细胞能够逃避机体免疫系统。 美国梅奥诊所Frank Sinicrope等的一项新研究显示,从基因层面改变癌细胞中的免疫调节蛋白,即增加CRC细胞的PD-L1蛋白表达,可使癌细胞对化疗更加敏感,从而可改善预后[4,5]。研究结果发表于《Oncogene》。 该研究的通讯作者Frank Sinicrope表示,该研究结果若被后续研究证实,则提示:肿瘤细胞PD-L1水平可能对药物敏感性很重要,并且增强PD-L1表达可能是改善CRC治疗结果的潜在策略。 ■ 研究细节研究者利用国家癌症研究所的癌症基因组谱数据库,来研究PD-L1表达与结肠癌患者生存之间的关联。 结果发现,肿瘤细胞PD-L1表达的增加与预期接受化疗患者的生存改善有关。这提示,肿瘤细胞PD-L1表达为潜在的预测生物标志物。 研究还发现,BRAF癌基因(一种可将正常细胞转化为癌细胞的基因)可调节PD-L1的表达;当BRAF癌基因发生突变时,可以使CRC细胞中PD-L1表达增加(图3)。
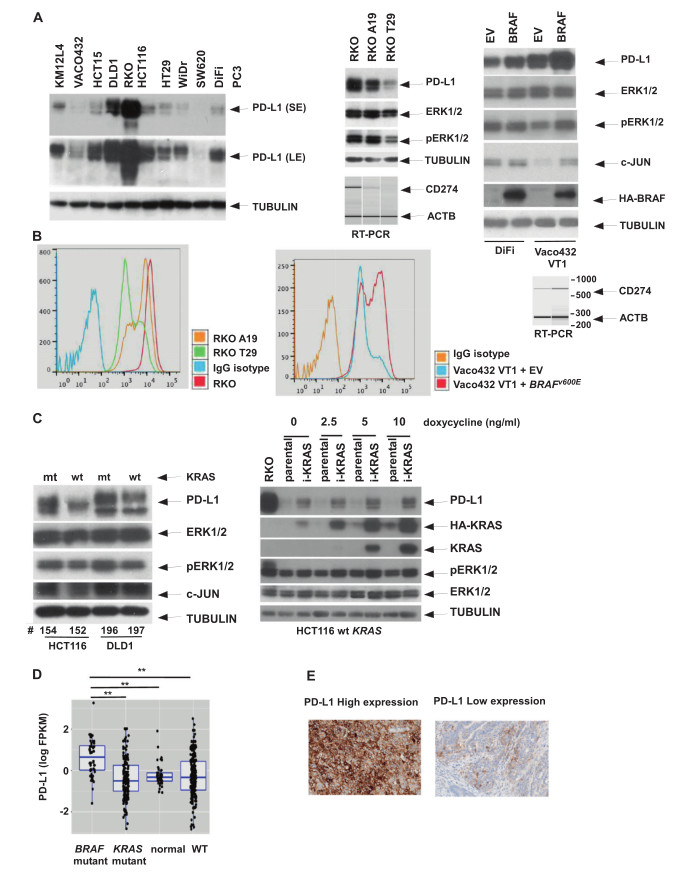
图3 BRAF V600E上调结直肠癌细胞中程序性死亡配体1的表达 此外,敲除PD-L1基因可抑制促凋亡蛋白BIM和BIK的表达。相反,恢复PD-L1表达则可逆转对这些蛋白的抑制。 研究的共同作者、Mayo Clinic肿瘤免疫学家Haidong Dong指出,目前针对PD-L1的疗法主要集中在阻断或破坏其在肿瘤细胞中的功能。该研究表明,肿瘤细胞PD-L1表达增加可能会促进化疗效果(至少在结肠癌中是这样的)。这是一个改变观念的发现,若能在临床试验中得到验证,将会为那些对当前化疗耐药的结肠癌患者带来更多获益。
参考文献
[1] https://www.sciencedaily.com/releases/2019/08/190823094825.htm
[2]Zhang J, Chen X, Yang R, et al. Thermally processed oil exaggerates colonic inflammation and colitis-associated colon tumorigenesis in mice[J]. Cancer Prev Res (Phila). 2019 Aug 23[Epub ahead of print]
[3]Huang W, Sundquist J, Sundquist K, et al. Use of Phosphodiesterase 5 Inhibitors Is Associated With Lower Risk of Colorectal Cancer in Men With Benign Colorectal Neoplasms[J]. Gastroenterology. 2019 Sep;157(3):672-681.e4.
[4] https://medicalxpress.com/news/2019-08-genetically-protein-colon-cancer-cells.html[5]Feng D, Qin B, Pal K, et al. BRAF V600E-induced, tumor intrinsic PD-L1 can regulate chemotherapy-induced apoptos is in human colon cancer cells and in tumor xenografts[J]. Oncogene. 2019 Aug 12[Epub ahead of print]