一款因“意外之喜”同时登上了两大顶级期刊《新英格兰医学杂志》和《柳叶刀》的药物,将有望改变未来肺癌的临床治疗格局。Canakinumab是否能够成为肺癌跨界明星?还要看CANOPY-1研究!
纵观医学史,你会发现很多的重大研究突破都是无心插柳柳成荫,比如青霉素的发现,就是因为弗莱明做完实验忘记洗盘子发现的;又比如西地那非一开始是奔着治疗心血管疾病去的,最后却成为了治疗男性勃起功能障碍(ED)的“传奇神药”。

青霉素的发现者亚历山大·弗莱明
因此,我们说科研不仅需要智慧,还需要意外和运气加持。 近几年最神奇的意外之喜,莫过于是一款针对心血管疾病的新型抗炎药物Canakinumab(卡那奴单抗,ACZ885 )。在一项国际大规模多中心临床试验(CANTOS)中意外发现Canakinumab居然有个显著的“副作用”:可以大幅降低肺癌发生率和死亡率。
跨界神药,一举成名
我们先来看一看让Canakinumab一举成名天下知的CANTOS研究。
CANTOS研究设计为随机、双盲、安慰剂对照的国际大规模多中心临床试验,共入选来自39个国家的10,061例合并超敏C反应蛋白(hs-CRP)升高(>2 mg/L)的心肌梗死患者。 所有患者在标准药物治疗基础上,随机分为 4 组:安慰剂组、Canakinumab 50 mg、150 mg 或 300 mg 组,Canakinumab 经皮下注射,3 月/次,中位随访时间 3.7 年。
主要终点事件包括非致命性心肌梗死、非致命性中风或由心血管疾病引起的死亡,次要终点事件包括主要终点的任意一个或是需要住院治疗的心绞痛、全因死亡。研究结果显示,Canakinumab可以在降脂药物治疗基础上进一步降低心肌梗死患者不良心血管事件的发生,为动脉粥样硬化的炎症假说提供了直接证据,也为后续更多炎症靶向药物的开发提供了依据。
Canakinumab除了把“正事”干好了以外,更为惊喜的就是刚刚提到的一项“副作用”了——显著降低肺癌发生率和死亡率。
在这次的万人队列CANTOS研究中,受试者都没有既往癌症史,且C反应蛋白水平高,昭示他们的炎症明显,还有24%的志愿者保持着吸烟的习惯,47%的志愿者过去有吸烟史,这些都是肺癌中公认的高风险因素。可以说CANTOS中的患者同时也是一个条件颇为理想的肺癌研究队列,既然这么好的队列都送到眼前了,不进行一发癌症的研究岂不浪费了?
研究人员均衡了每个试验组的吸烟人数,最终的结果没有让他们失望,使用Canakinumab的3个试验组所有癌症的发病率、发病风险和死亡率、死亡风险均较安慰剂组有下降,且用药剂量越大,下降程度越高,其中300mg组的癌症死亡率减少了69%,死亡风险仅为安慰剂组的49%!
如果单看肺癌一项的数据则颇为亮眼。相较于安慰剂组中肺癌占全部癌症发病的26%和死亡的47%,Canakinumab组则分别只有16%和34%。其效果因剂量而异,在每三个月使用300 mg剂量Canakinumab的患者中观察到肺癌的相对发生率降低了67%(HR 0.33,95% CI: 0.18-0.59),肺癌死亡率降低了77%(HR 0.23,95% CI: 0.10-0.54)[1]。
凭实力跨界,为何不可?
俗话说,不想当厨子的裁缝不是好司机,不想降低肺癌发生率的药也不是好的心血管药。如果要说“跨界”跨得好,实力也不能少。那么, Canakinumab绝对可以称得上一个极具潜力的选手了。
Canakinumab是一种人源化单克隆白细胞介素-1β(IL-1β)特异性抗体,对其他IL-1家族没有结合能力,IL-1ß是一个重要的调节免疫系统的蛋白,活性过高可导致自身免疫紊乱,进一步可能导致动脉粥样硬化等心血管问题。
Canakinumab是一种靶向IL-1β的人源化单克隆抗体,那么为什么Canakinumab会对肺癌有“奇效”呢?
▍炎症与肿瘤,剪不清理还乱
长久以来,肿瘤和炎症之间的相互关系在科学研究中存在着一些争议。
早在19世纪中叶,德国病理学家Rudolf VirchoW就在肿瘤组织中观察到了浸润的白细胞,据此首次提出了炎症与肿瘤之间可能存在着某种联系的观点——认为肿瘤的起源与慢性炎症有关。然而,随着流行病学和分子生物学技术的发展,越来越多的研究表明炎症与肿瘤之间存在密切联系。各种炎症因素通过参与、改变微环境的形成影响肿瘤的发生与转移,以及肿瘤对于治疗的反应。
图源网络
近期,《Cell》发表的一篇炎症与肿瘤的综述指出,炎症容易导致癌症的发展,并促进了所有阶段的肿瘤发生。癌细胞与周围的基质细胞和炎性细胞相互作用,形成肿瘤炎性微环境(TME)[2]。
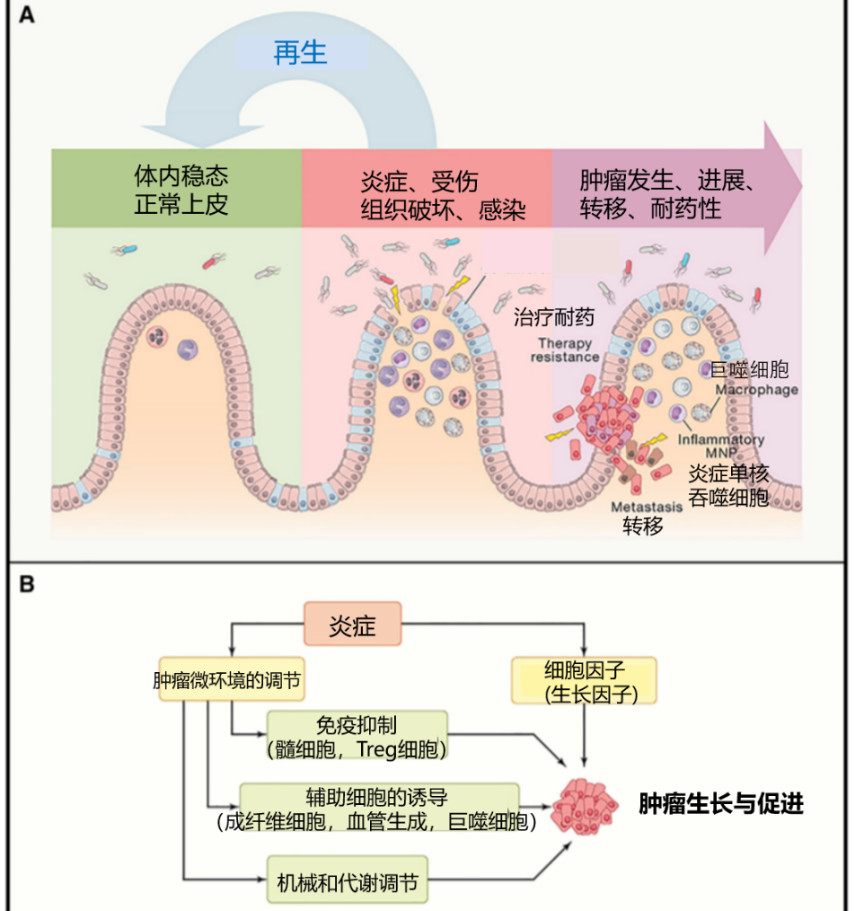
炎症在进展、转移和生长中的促肿瘤作用
▍IL-1β介导肿瘤发生、发展和转移的多个阶段
IL-1β是第一个被发现的白细胞介素, 其DNA于1984年克隆成功。最初发现其主要功能是作为内生性致热源参与炎症反应。因此,IL-1β就是炎症因子的一种,且具有很强的生物活性。IL-1β不仅可以介导炎症反应,还可以诱导环氧化酶2(COX-2)、IL-6等炎症因子的表达,从而进一步激活基质细胞和免疫细胞产生更多的IL-1β参与炎症反应[3]。
已经有研究证明,IL-1会参与化学诱导的小鼠纤维肉瘤的发展、进展[4],以及石棉诱导的间皮瘤的发展[5],或吸烟者中非小细胞肺癌的发展[6]。而阻断IL-1已被证明能够延缓小鼠和人类的肿瘤进展[7,8]。
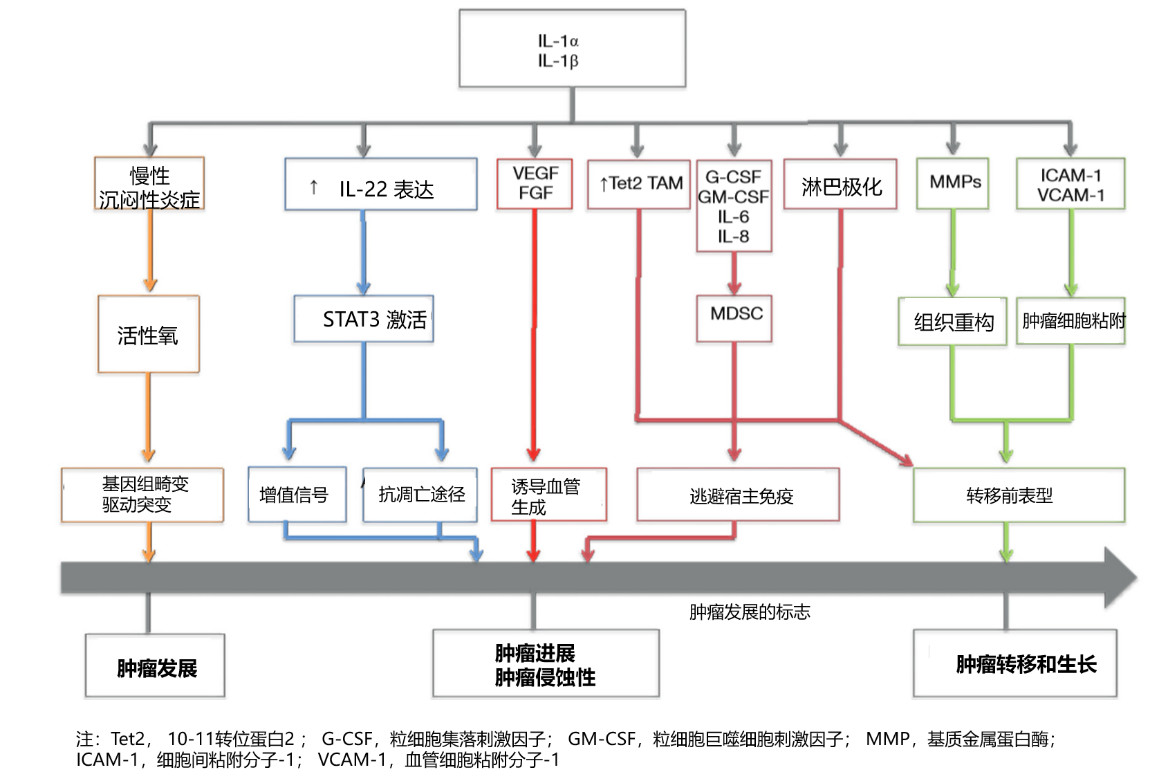
IL-1促肿瘤作用的示意图概述
Apte等人假设IL-1介导的突变活性氧(ROS)诱导促进了癌前病变的形成。通过对肿瘤细胞、基质细胞和免疫细胞的自分泌或旁分泌刺激,IL-1诱导血管内皮生长因子(VEGF)和成纤维细胞生长因子(FGF)的表达[9]。这些促血管生成的分子导致毛细血管的新形成,为肿瘤的生长提供一个更加可持续的微环境。
IL-1直接但也依赖于IL-1分泌的促炎细胞因子和趋化因子,如IL-8与骨髓源性抑制细胞(MDSC)的募集密切相关此外,最近的研究已经证明了IL-1信号在维持肿瘤相关巨噬细胞(TAM)免疫抑制能力方面的担任了重要角色。在CANTOS试验中,阻断IL-1可能削弱了这些未成熟细胞的募集,从而削弱了肿瘤的免疫逃逸机制,并使免疫系统更有效地清除了恶性前细胞或小的肿瘤。
如果指向另一种机制,最近发现在小鼠和人类乳腺癌和肺癌模型中IL-1依赖性IL-22表达的上调。也有研究证实肺癌患者和其他肺部疾病的灌洗液中存在IL-22 。沿着这些思路,有研究发现小鼠乳腺癌细胞在使用IL-1阻断剂后,肿瘤生长减少,同时IL-22表达减少,说明这两种细胞因子之间的密切联系[7]。然而,IL-22在肺癌进展中的作用仍不明确,需要进一步研究。
总而言之,随着对 IL-1β的深入研究,未来将会对IL-1β在不同类型肿瘤中发挥的作用更加深入,并有可能为肿瘤治疗提供新的靶点。
改变临床治疗,机会来了!
我国是肺癌大国,治疗手段从手术、放化疗等传统治疗手段到靶向、免疫等新兴疗法,每一次的进步和转变对患者来说都是巨大的“福音”。在没有发现驱动基因突变以前,我们也无法想象靶向治疗能够显著提高患者的生存获益。而早在一个多世纪前,美国骨科医生William Coley用酿脓链球菌感染癌症患者的肿瘤组织,被认为是肿瘤免疫治疗理念的雏形,直到2013年肿瘤免疫治疗才被《Science》杂志评为年度最重要的科学突破。
谁能否定IL-1β不会成为肿瘤治疗史上又一重要转折点呢?CANTOS 研究过程中的“无心插柳”给了我们进行下一个阶段研究的契机,并且我们有足够的理由相信 Canakinumab可以在肺癌患者中发挥作用。
目前,这个机会来了。一项 Canakinumab (ACZ885)对比安慰剂辅助治疗完全切除的NSCLC的有效性安全性的III期、多中心、随机、双盲、安慰剂对照研究正在进行患者招募中。
本试验的适应证是辅助治疗完全切除(R0)的、AJCC/UICC v.8 II-IIIA期和IIIB期(T>5cm N2)的非小细胞肺癌(NSCLC)。
研究在局部晚期或转移性NSCLC的受试者中评估在4个周期的Canakinumab vs. 安慰剂联合帕博利珠单抗及以含铂化疗之后,在总疗效达到疾病稳定或更佳结果的受试者中继续给予维持治疗的疗效和安全性。在随机、对照部分之前将有一个安全性导入部分,其中将确认使用Canakinumab联合帕博利珠单抗及以铂类为基础的双联化疗的推荐剂量。
医学的进步让我们有了很多的治疗选择,肿瘤学家可以更精准地选择具有更好结果和更好耐受性的疗法,对患者来说是一件好事。越来越多肺癌患者将在科学指导和精准医疗指导下,合理地轮换药物,为患者带来更长的生存获益。 不得不说,我们处在一个充满奇迹的时代,快速发展的医疗科技不断给人类带来了新的惊喜。Canakinumab目前所展现出极具潜力的抗癌效应,相信又是未来的一大惊喜和转折……
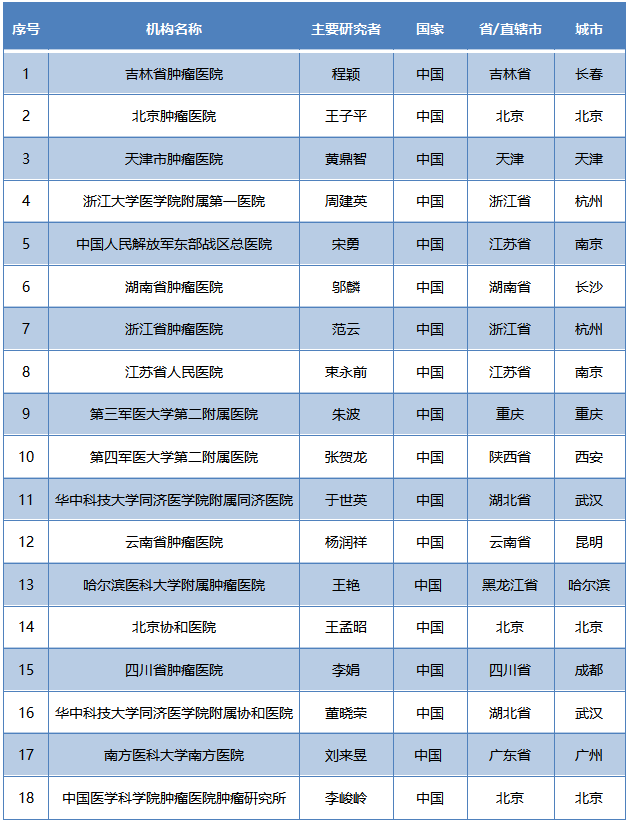
CANOPY-1研究目前在中国多个中心正在入组NSCLC晚期一线患者(信息来自国家药品监督管理局“药物临床试验登记与公示平台”)
★ 参与单位如下表
参考文献
[1] Ridker,PM, et al. Effect of interleukin-1β inhibition with canakinumab on incident lung cancer in patients withatherosclerosis: exploratory results from a randomised, double-blindplacebo-controlled trial. The Lancet. 2017;S0140-6736(17)32247-X.
[2] Greten FR, Grivennikov SI. Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity. 2019 Jul 16;51(1):27-41.
[3] Apte R N, Voronov E. Interleukin-1——a major pleiotropic cytokine in tumor-host interactions. Semin Cancer Biol, 2002, 12:277-290.
[4] Krelin Y, et al. Interleukin-1β– Driven Inflammation Promotes the Development and Invasiveness of Chemical Carcinogen–Induced Tumors. Cancer Research 2007;67:1062.
[5] Kadariya Y, Menges CW, Talarchek J, et al. InflammationRelated IL1β/IL1R Signaling Promotes the Development of Asbestos-Induced Malignant Mesothelioma. Cancer Prev Res (Phila) 2016;9:406-14.
[6] O’Callaghan DS, O’Donnell D, O’Connell F, et al. The Role of Inflammation in the Pathogenesis of Non-small Cell Lung Cancer. J Thorac Oncol 2010;5:2024-36.
[7] Voigt C, May P, Gottschlich A, et al. Cancer cells induce interleukin-22 production from memory CD4(+) T cells via interleukin-1 to promote tumor growth. Proc Natl Acad Sci U S A 2017;114:12994-9.
[8] Holen I, Lefley DV, Francis SE, et al. IL-1 drives breast cancer growth and bone metastasis in vivo. Oncotarget 2016;7:75571-84.
[9] Apte RN, Dotan S, Elkabets M, et al. The involvement of IL-1 in tumorigenesis, tumor invasiveness, metastasis and tumor-host interactions. Cancer Metastasis Rev 2006;25:387-408.
[10] Mantovani A, Barajon I, Garlanda C. IL-1 and IL-1 regulatory pathways in cancer progression and therapy. Immunol Rev 2018;281:57-61.
*文章来源于 网络,版权归原作者所有,如有侵权请联系删除