抗生素使用增加结肠癌风险?
美国约翰霍普金斯大学医学院Cynthia L Sears等的一项病例对照研究显示,口服抗生素使用(尤其是抗厌氧菌抗生素)与结肠癌风险(特别是近端结肠)增加相关;直肠癌则与之相反,抗生素使用反而会降低其发生风险。这表明结肠和直肠的肠道菌群和癌症发生机制存在差异[1-2]。研究结果近日发表于《Gut》。 在全球范围内,抗生素使用持续增长,从2000年到2010年,消费量每年增加35%,增至700亿剂,这相当于地球上每人消费10剂。这些惊人的数字推动研究人员探索抗生素对人类健康的影响。 早期研究发现抗生素与癌症之间存在关联,但是目前的证据存在一些局限性,例如:招募的参与者人数相对较少,没有考虑吸烟、酗酒等癌症风险因素,研究依靠参与者自我报告抗生素使用情况而缺乏药物的类型和剂量信息等。鉴于前述情况,该项新研究的作者表示,其目的是在世界上最大的初级保健数据库中调查抗生素使用与特定部位结直肠癌风险之间的关联。
■ 研究细节
研究者从1989-2012年临床实践研究数据链中获取数据。该数据库包含来自英国674个医生办公室的1130万人的匿名医疗记录,这些记录包含有关医生开具的药物类型、剂量以及指示患者如何服药的详细信息。 研究者共提取了19726名结肠癌患者和9254名直肠癌患者的医疗记录,还收集了137077名没有肠癌者(对照组)的信息,并按年龄和性别匹配。 结果显示,中位随访8.1年,肠癌组和对照组分别有70%和68.5%的人服用抗生素。与没有肠癌的对照者相比,结肠癌患者更可能服用抗生素(69.1% vs 71.3%),而直肠癌患者抗生素服用情况相当(67.2%vs 67.1%)。 抗生素对肠癌风险的影响因肿瘤部位而异。而且,抗生素用量越大,结肠癌风险越高(趋势P<0.001),尤其是近端结肠。相反,抗生素使用与直肠癌风险呈负相关(趋势P=0.003);与未使用抗生素相比,使用抗生素超过60天与直肠癌风险降低15%相关(aOR=0.85,图1)。
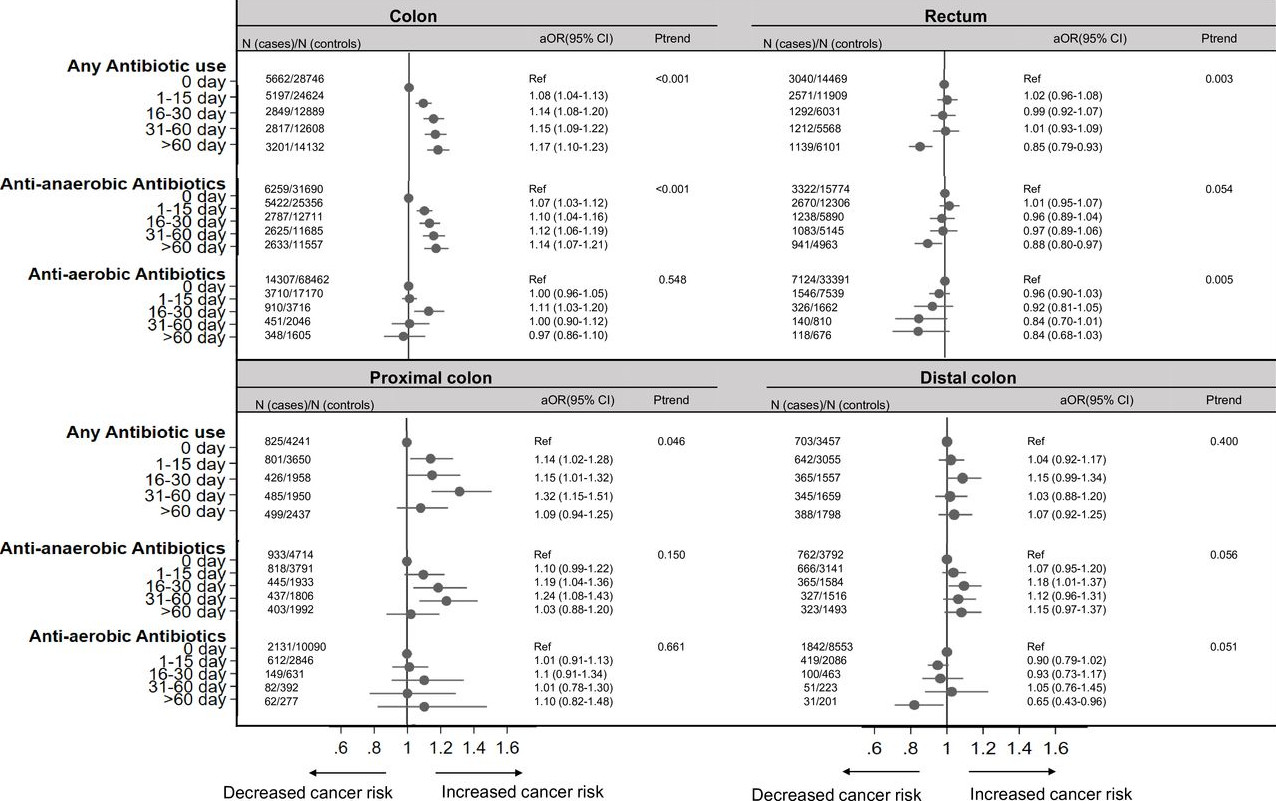
图1 抗生素使用对结直肠癌风险影响的aOR森林图 各类抗生素对结直肠癌风险的影响不同。抗厌氧菌抗生素增加结肠癌风险增加(图1),而抗需氧菌抗生素未增加这一风险;青霉素类(尤其是氨苄西林/阿莫西林)增加结肠癌风险(aOR=1.09),而四环素类降低直肠癌风险(aOR=0.90,图2)。
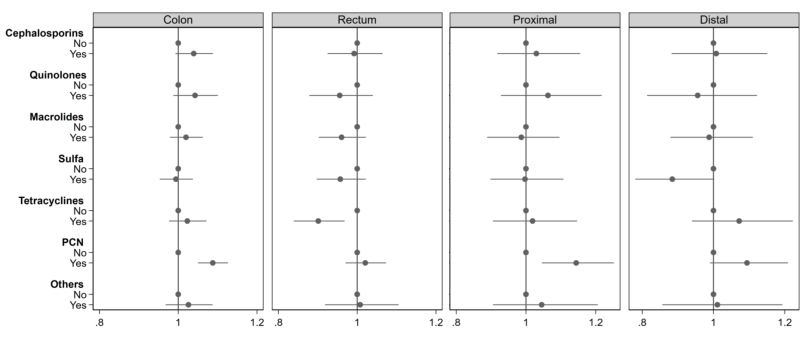
图2 不同类别抗生素和不同部位癌症的aOR森林图 此外,诊断前抗生素暴露>10年与结肠癌风险增加相关(aOR=1.17)。作者表示,抗生素与癌症风险之间的关联似乎是长期存在的。
结肠手术无需肠道准备?
芬兰赫尔辛基大学医院Laura Koskenvuo等的一项多中心、随机、平行、单盲试验显示,与不做肠道准备相比,结肠手术前进行肠道准备并不能降低手术部位感染或手术并发症的发生[3-4]。研究结果发表于《the Lancet》。近几十年来,欧洲患者行结肠手术时并未常规进行肠道准备,但在美国术前清洁肠道相对常见。基于数项回顾性研究结果(联合术前口服抗生素的肠道准备似乎可显著减少手术部位感染的发生),美国外科学会建议结肠切除术前进行肠道准备。然而,在芬兰,由于缺乏随机研究,迄今为止对肠道准备持保留态度。文章通讯作者Koskenvuo表示,肠道准备对患者来说是一个压力很大的过程。因此,只有在真正使患者受益的情况下进行肠道准备才是合理的。研究者、赫尔辛基大学医院Ville Sallinen指出,该研究显示,两组之间的治疗结果没有差异,肠道准备并没有减少手术部位感染或手术并发症的病例数或严重程度,住院时间也没有任何差异。■ 研究细节该研究纳入需行结肠手术的患者,其中近80%患者患结直肠癌,并将患者按1:1随机分入机械性和口服抗生素肠道准备(MOABP)组或无肠道准备组(NBP)。主要终点为术后30天内手术部位感染。改良的意向治疗分析纳入396例患者(MOABP组196例,NBP组200例)。
结果显示:
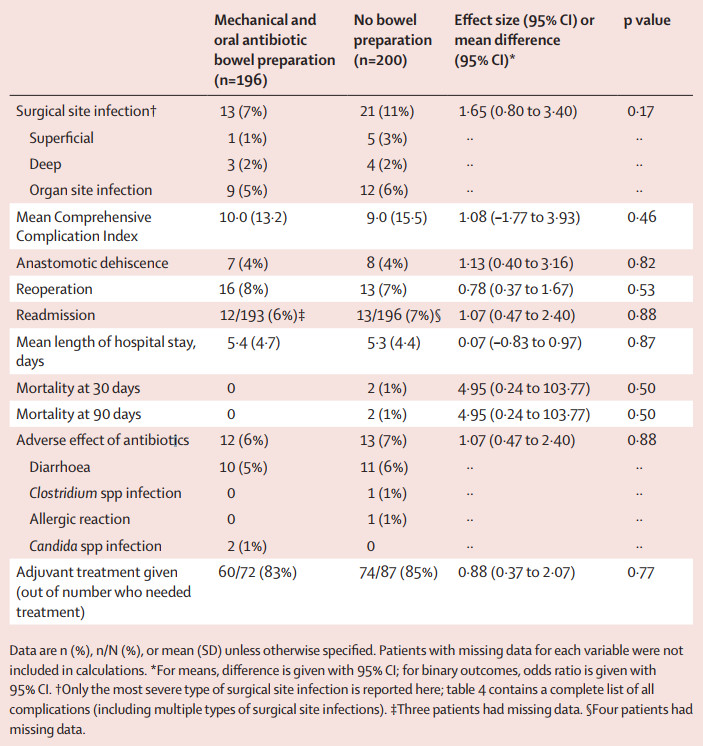
MOABP组有13例(7%)出现手术部位感染,NBP组有21例(11%),无显著统计学差异(OR=1.65,p=0.17);
MOABP组7例(4%)和NBP组8例(4%)患者报告了吻合口裂开,MOABP组16例(8%)和NBP组13例(7%)需要再次手术;
术后30天内,NBP组有2例死亡,而MOABP组无死亡病例(表1)。
表1 研究的主要和次要终点数据
阿帕替尼治疗难治性转移性结直肠癌有效
一项开放标签、单臂、Ⅱ期研究显示,阿帕替尼单药治疗难治性结直肠癌有效,尤其是体能状态(PS)评分0-1或无肝转移患者[5]。研究结果发表于《the Oncologist》,南京医科大学第一附属医院顾艳宏教授与常州市第二人民医院蒋华教授为共同通讯作者。 该研究纳入组织学诊断的结肠或直肠腺癌、先前接受过至少2种标准治疗方案的患者。在3线或以上治疗中,给予口服阿帕替尼500 mg/d。利用含1021个癌症相关基因的panel进行动态捕获测序,以识别ctDNA的体细胞变异。 主要终点是无进展生存期(PFS)和根据实体瘤疗效评估标准(RECIST)1.1版确定的肿瘤缓解率。 研究共纳入26例患者,结果显示:
中位PFS为3.9个月,中位总生存(OS)为7.9个月。
PS 0~1患者的PFS显著长于PS 2患者(4.17个月 vs 1.93个月,图3);
无肝转移患者的PFS显著长于有肝转移患者(5.87个月 vs 3.33个月,图4)。
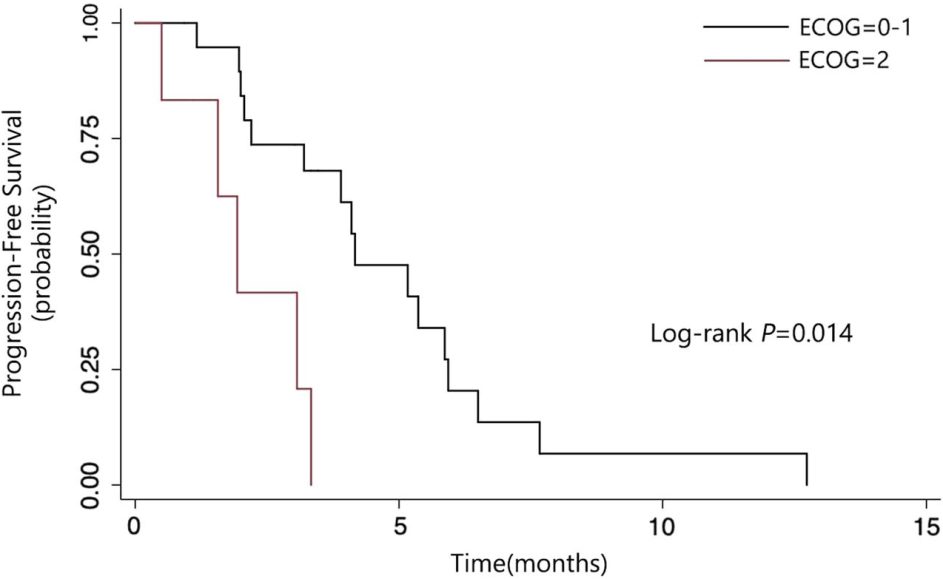
图3 按ECOG体能状态分层的无进展生存情况
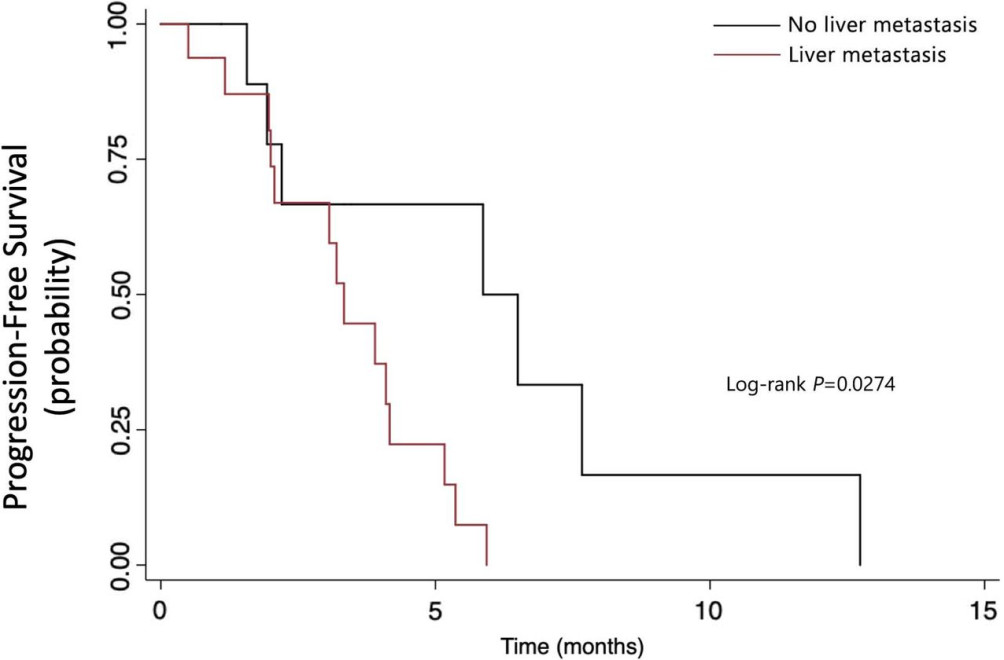
图4 按有无肝转移分层的无进展生存情况 阿帕替尼的常见不良反应包括高血压、手足综合征、蛋白尿和腹泻。所有患者均因不良事件而减少治疗剂量。此外,研究还发现,常见的APC、TP53和KRAS基因突变与PFS和OS无显著相关性,这可能与研究样本量小有关。在13例接受连续ctDNA检测的患者中,10例在影像学疾病进展前已发现ctDNA丰度增加,这表明ctDNA检测与影像学肿瘤负荷有关。总而言之,该研究为“阿帕替尼治疗难治性结直肠癌有效”提供了支持性证据,尤其是对PS 0–1和无肝转移患者的治疗。鉴于该研究样本量小,未来需在更大型研究中验证该研究结果。
参考资料
[1]Zhang J, Haines C, Watson AJM, et al. Oral antibiotic use and risk of colorectal cancer in the United Kingdom, 1989-2012: a matched case-control study[J]. Gut. 2019 Aug 19 [Epub ahead of print] [2]https://www.medicalnewstoday.com/articles/326113.php
[3] https://www.sciencedaily.com/releases/2019/08/190812102844.htm
[4]Koskenvuo L, Lehtonen T, Koskensalo S, et al. Mechanical and oral antibiotic bowel preparation versus no bowel preparation for elective colectomy (MOBILE): a multicentre, randomised, parallel, single-blinded trial[J]. Lancet. 2019 Aug 8 [Epub ahead of print]
[5] Chen X, Qiu T, Zhu Y, et al. A Single-Arm, Phase II Study of Apatinib in Refractory Metastatic Colorectal Cancer[J]. Oncologist. 2019;24(7):883-e407.