策划/总监:廖怀凌
顾问/审校:杨浩贤
摄像/监制:李凯健
编辑/后期:余金恩、冯建扬
广东台《健康大湾区》联合广州抗癌协会推出《肿瘤名家讲坛》系列报道,传递国际国内肿瘤防治最新、最权威的资讯。今天(2020年8月10日)刊播第三集:广东省肺癌研究所名誉所长吴一龙教授分享肺癌国际研究新进展——《ASCO(美国临床肿瘤学会)肺癌靶向治疗新进展》。

吴一龙,主任医师、博士生导师。广东省人民医院肿瘤中心终身主任、广东省肺癌研究所名誉所长、广东省肺癌转化医学重点实验室主任、吴阶平医学基金会肿瘤医学部主任委员、中国临床肿瘤学会前任理事长、中国医师协会精准医学专业委员会副主任委员、广东省临床试验协会会长、中国胸部肿瘤协作组主席、欧洲肿瘤学会中国区总代表。国家科技进步二等奖获得者(第一完成人)。
吴一龙教授于2020年7月17日在广州举行的第十四届“中国临床肿瘤学会(CSCO)-南方肿瘤高峰论坛暨番禺肿瘤论坛”上分享相关研究进展。经吴一龙教授本人审核、授权,在大会上的发言和PPT如下:

今年给大家谈三个方面,第一个方面是谈谈靶向治疗。靶向治疗今年有两个非常重要的临床试验,这两个临床试验奠定了辅助靶向治疗的位置。第一个就是我们的CTONG1104的研究。

记得三年前的2017年我在美国的ASCO大会做了大会报告,给大家看这个生存曲线,可以看到,手术之后对于有淋巴结转移的病人,我们用易瑞沙可以减缓患者复发的时间。DFS的时间整整增加了10个月左右,中位时间一个是30.8个月,一个是19.8个月,有10个月差别。
这个报告之后,很多人提出了同样一个问题:这一种延迟复发能不能变成总生存的获益?也就是说是不是这个病人能活得更长?我们今年报道了总生存的结果。在总生存的结果,我们看到了这两条生存曲线实际上从第4年到第5年开始,它们就重叠在一起,也就是说它的DFS的获益,没有最后转变成OS的获益。
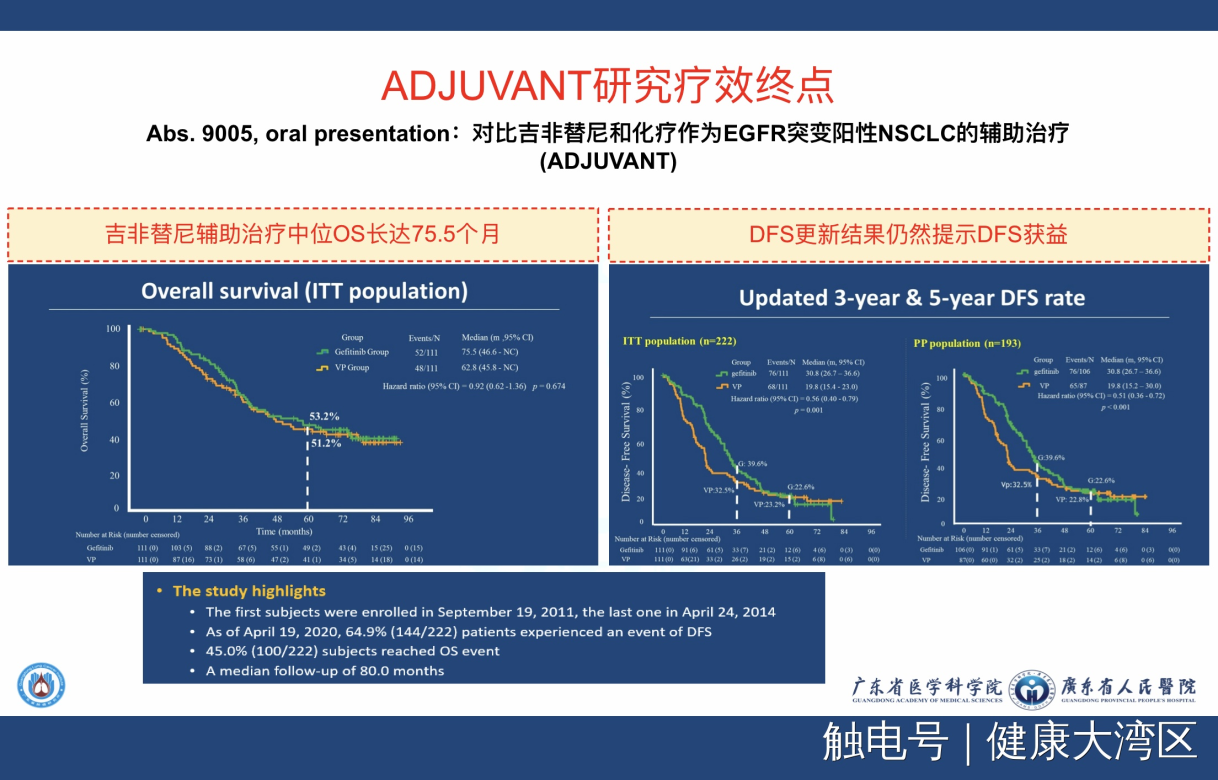
但是我们可以看到一个非常有意思的事情是什么呢?在我们这个研究里面,现在已经达到全球同类研究随访时间最长的80个月,这80个月的时间出现了这样的结果,就是迄今为止所有的辅助治疗里活得最长的——中位时间已经达到了75.5个月,而对照组只有62.8个月,虽然统计学没意义,但是实际上它是患者活得最长的研究。
在某个意义上来讲,这实际上告诉我们,对于有EGFR突变的早期患者,只要能够用得上靶向药物,那么所有患者活得时间是非常长的,是目前可以达到最长的时间。这次我们再次在ASCO大会报道了它的最后结果,也就是这个临床研究,两次登上ASCO大会,这也是比较少见的。
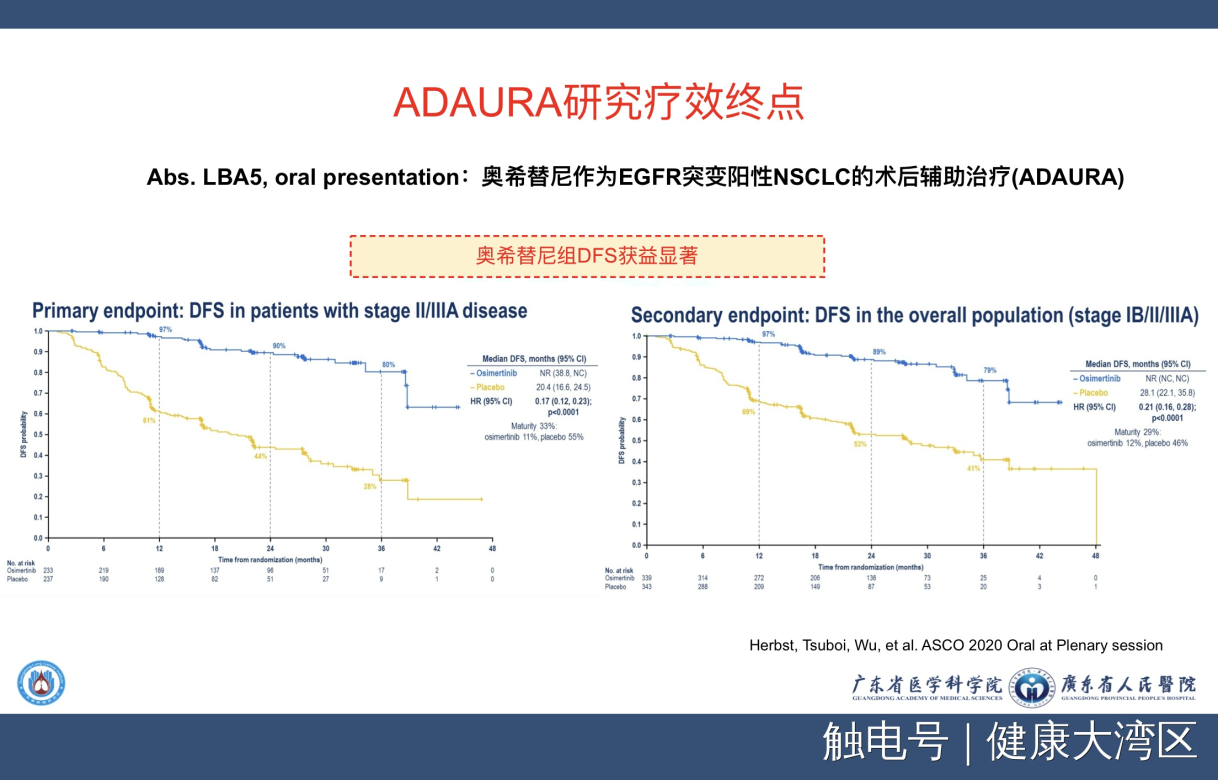
在这个研究之后,我们来看看第二个非常重要的研究,就是ADAURA的研究。大家也非常熟悉了,这一个就是用第三代的EGFR-TKI—奥希替尼,来做辅助靶向治疗。这个研究的全球的PI是由美国的Herbst,日本的Tsuboi,还有我,三个人领导这个临床试验。
我们今年报道的这个结果是非常有意思的,它的HR值0.17,就是II-III期是0.17。如果把Ib期放进去是0.21,这么低的HR值在历史上非常少见,也就是减少复发达到了80%多以上。
因为有了这么好的结果,独立数据委员会认为这样的一个研究应该尽早公开,应该揭盲,不应该持续盲态,让我们的患者更多地获益,所以就公开了这个研究,整整提早了两年的时间来公布这个结果。
实际我们可以看到这个靶向药物奥希替尼,让我们的患者获益是非常大的。而这条对照组的生存曲线,也就是说黄色这条线跟我们ADJUVANT研究的对照组,两条曲线我们进行了磨合,完全重叠在一起。
也就是说这两个研究的数据都是非常稳健、非常可信的一个结果。所以这第二个研究也证实了辅助靶向治疗它的优越性。我们来看看到现在为止所发表的辅助靶向治疗的三期临床试验有这么多,头两个是BR19和RADIANT研究,这两个也是靶向治疗,但是他们并不是选择突变的患者,所以他们两个并没有做出生存的差异。

下面的ADJUVANT和ADAURA三期的研究,做出了临床意义。我们也非常高兴看到了前几天贝达公司提早公布了他们的Evidence的结果,这个结果的设计跟我们ADJUVANT研究的设计几乎是一模一样,但是他用了一个埃克替尼来对这个化疗,他们的研究两年的DFS也取得了阳性的一个结果。
所以这么多研究放到一起,实际上告诉我们辅助靶向治疗实际上已经证实了它确实是延长患者的无复发、无进展的时间,这是总体的结果。今天可能没有人再来怀疑这个问题了。

好了,我们来谈谈几个需要思考的问题,就说究竟我们今天来讲是看OS,还是看DFS?这是我们所有人都要思考的问题。
我们的结果公布了之后,非常有意思的是全球基本上分成了两大阵营:一大阵营就坚决认为我们今天对于可手术的病人,因为病人是可以治愈的,所以我们一定要看OS。另外一派的意见就认为说今天所有的病人在进展之后活的时间非常长,后面的治疗干扰的因素太多,再也没有一个研究可以做出OS的差异,所以认为DFS就够了。这两个观点一直在争论。我个人认为即使是ADAURA研究,它将来也没办法做出OS的差异,因为活的时间太长了,你想想我们ADJUVANT研究,30个月出现了进展,而它的中位生存期是75个月,也就是说后面活的时间比前面的进展时间还要长,这种因素是控制不了的,所以我认为OS很难,几乎是没办法做出差别出来的,所以DFS非常重要。
我们看到了有一个美国的医生,他看到了我们ADJUVANT的6条生存曲线,他说他看到了这6条曲线,他就更坚定了,只要是有靶向药物,我们有机会一直让病人用靶向药物,这些病人肯定生存是长的,而没有机会来获得靶向治疗的病人,他的生存时间是最短的,所以这是说的第一个问题。
第二个问题,现在我们的标准治疗是辅助化疗,那究竟是辅助化疗之后再来吃靶向药物呢,还是说我们不需要辅助化疗,就直接用靶向药物?我们来看看这是Camidge,他是坚定地要看OS的结果,是美国Colorado的教授,他讲的非常有意思的,他说中国人做了ADJUVANT研究,他是用化疗跟靶向药头对头,为什么阿斯利康后来要做这么一个先做化疗之后,才来吃、才来用这个靶向药物呢?他认为这样的的设计,把靶向药物跟安慰剂对照,他认为是不合理的,他认为是这样的。
然后我们来看看我们CTONG1104研究实际上告诉你什么呢?我跟化疗头对头,我们两者没有差别,所以我认为说没有辅助化疗,病人仍然活得最长,这是我们CTONG告诉你的。然后我们再看看另外一个胸外科医生,他说如果我们在晚期病人看到的靶向药物有这么好的结果,我们所有人都说要做这个辅助化疗,但是辅助化疗只有5%的获益,为什么要做辅助化疗呢?他的意见是这样。特别重要的是ADAURA的研究,做不做辅助化疗,它的HR值都是一样、接近的。因此我们可以看到了,这个问题慢慢出来了,凡是有一个突变的病人,其实不需要去做辅助化疗,你能够取得非常长的生存结果。这是第二个问题。
第三个问题,靶向药物用药的时间究竟要用多长时间呢?用一年、用两年、用三年,或者像乳腺癌用了四年、五年、六年,这个问题今天没有答案。但是我们一个亚组分析发现,如果这个病人有机会用的更长的话,这个患者是活得更长。是两年还是三年?我现在没有这个结论,但是起码做所有的研究告诉我们,至少应该用两年以上,这就是我们需要思考的问题。所以我觉得今年在靶向治疗,非常明显的就把晚期的所用的靶向药物,把它推到了早期阶段。

现在让我们来看看联合治疗。因为我们也知道用靶向治疗一段时间之后,很多病人效果并不是特别理想,我们来看看联合治疗的问题。
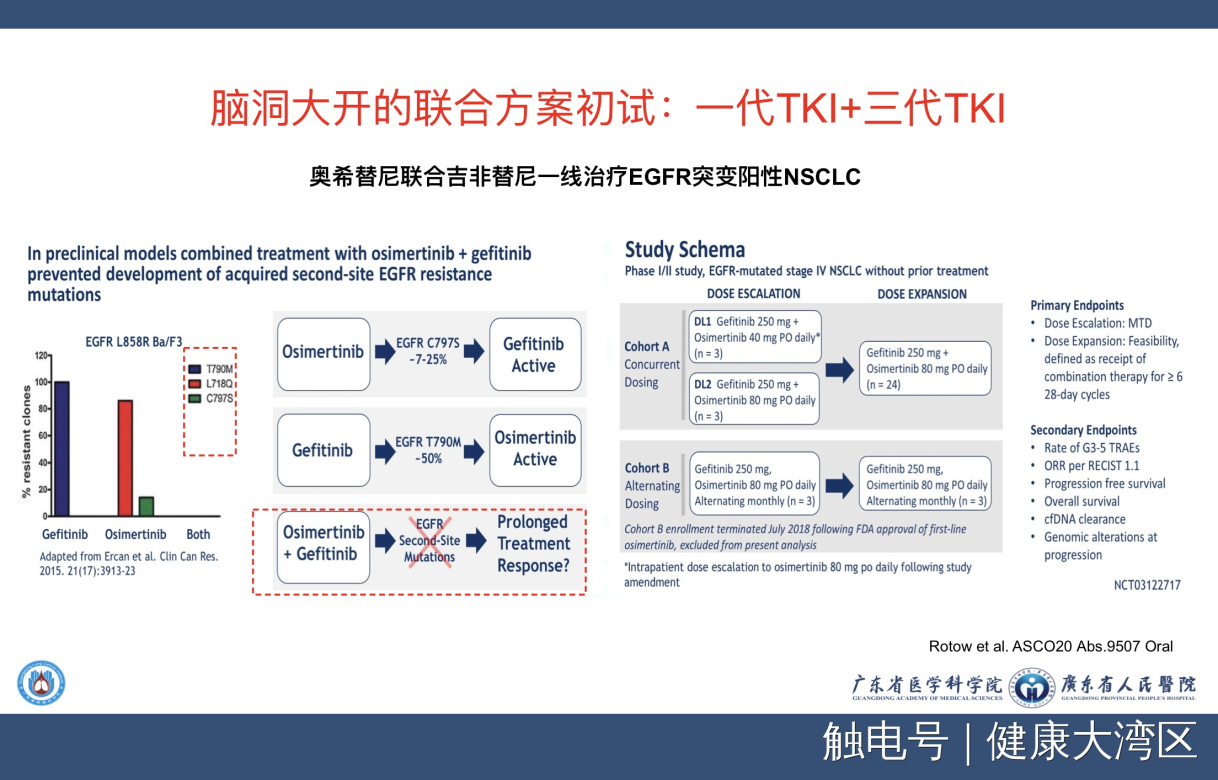
这个联合治疗我用了一个词叫做脑洞大开,什么脑洞大开呢?我们大家知道,EGFR-TKI是从一代二代三代这么发展过来的,但是这个临床研究,它居然设计了一个第一代加上第三代药物这样的一个研究,研究的基础是什么?研究的基础是在右边这个图,我们可以看到,它的科学基础是用了吉非替尼之后,出现EGFR T790M是它的主要耐药机制。吉非替尼出现了EGFR T790M,奥希替尼是克服这个耐药基因的,所以如果是在吉非替尼之后用上奥希替尼,那应该是非常好的一个假设。现在看奥希替尼耐药之后出现什么呢?出现了C797S,还有L781Q这两个是为主的。但是你如果用第一代的话,是不出现这两个耐药机制。因此就变成在科学上有个合理的地方,把这两个合到一起,可能就不会出现T790M,也不会出现C797S,那就是它的科学基础。
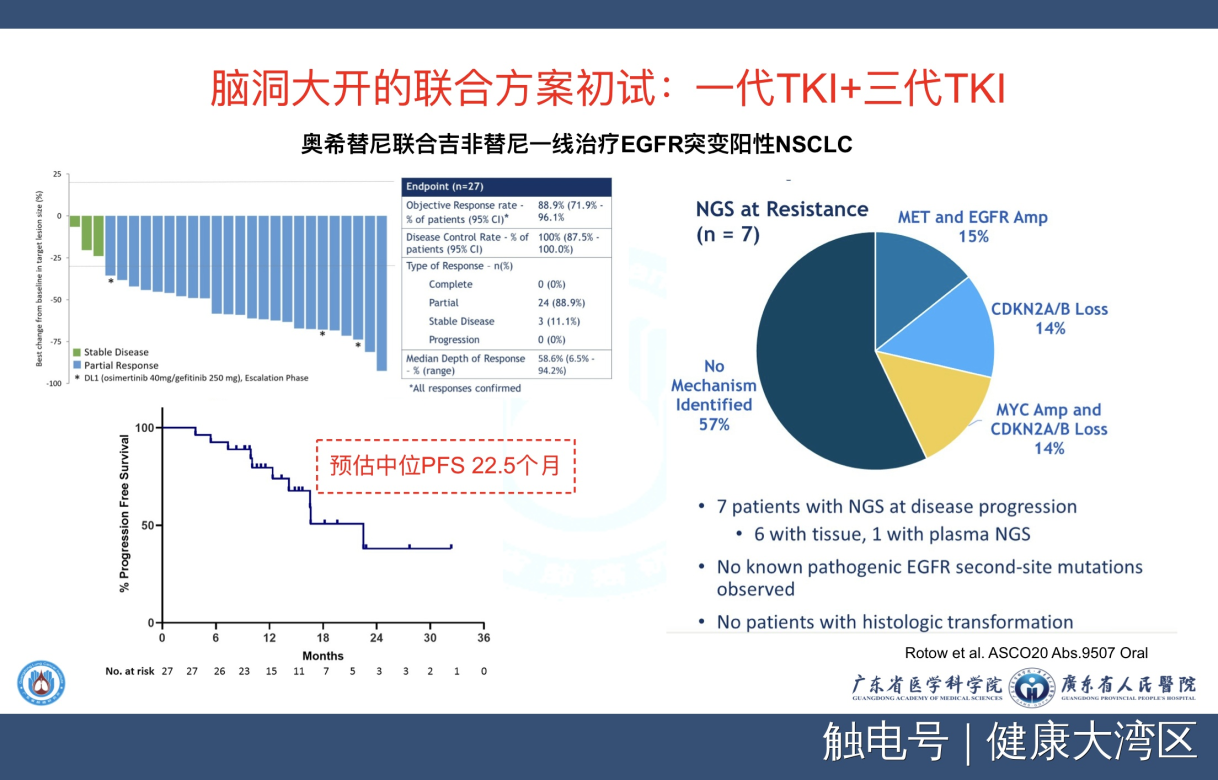
在这个科学基础上,就设计了这样一个临床试验,就是奥希替尼之后用吉非替尼,或者吉非替尼后奥希替尼,就是这样的一个研究。这两个联用之后,就可以把会出现耐药的那种突变全部把它减到没有,所以就变成这样的一个设计。这个设计是非常有意思的,你们看到那个瀑布图,联用之后没有看到一个病人有进展的。而且他的有效率达到了89%,比起我们传统的用单个药的70%又提高十几个百分点。而且它的中位PFS预计可以达到22.5个月。你们想想,我们FLAURA的研究多少?19.6个月,我们在吉非替尼多少?10个月到11个月,两个联合起来,可以把它用成这样的一个结果。我们再来看看,用了这两个药,这个图是它出现耐药的情况,这个耐药情况我们真的是看不到了T790M,看不到了经常讲到的C797S,都看不到了。反而出现了一个cMET的扩增,成为一个非常为主突变。我们通过这个研究,实际上我们的思路越来越开阔。这个思路开阔,就是根据药物作用的机制跟它耐药的情况,我们重新来设计使用的方法。那就是给我们的一个非常好的启发。

另外,这是四川省人民医院曾主任他们做的一个研究,在这个研究里面今年也被ASCO列为大会报告。这个大会报告里面他最出彩的地方是什么呢?就是当晚期的病人使用TKI,发现有比较孤立的转移。这个孤立转移就是五个病灶以下的转移。在这个情况下把立体放疗加进去,全身用药加上局部放疗,他们得到一个结果是什么呢?PFS跟OS,都有了统计学意义。这是今年的ASCO大会口头报告。这个报告实际上给我们提出了全身治疗加上局部治疗是能够获益的。所以我们可以看到今天的局部治疗已经不是局限在早期跟中期的病人,它也往晚期的病人推进。这个研究在学术界的争论最大的问题是在这个地方。我们可以看到,今天我们所有人都知道EGFR TKI在肿瘤进展之后,后面生存的时间还是非常长的。
那在这个研究为什么OS 从17个月到25个月只增加了8个月的时间。这一点大家一直在疑问,为什么这个总生存这么短?因为按照今天我们的ADJUVANT研究也好,包括我们现在 FLAURA研究,这个中位生存时间起码超过3年以上的,4年的,所以大家提出了一个疑问,为什么是这样?如果这个问题不解决,局部治疗用上去也会受到很大的挑战,是不是说用了之后OS没有达到最好的一个结果?

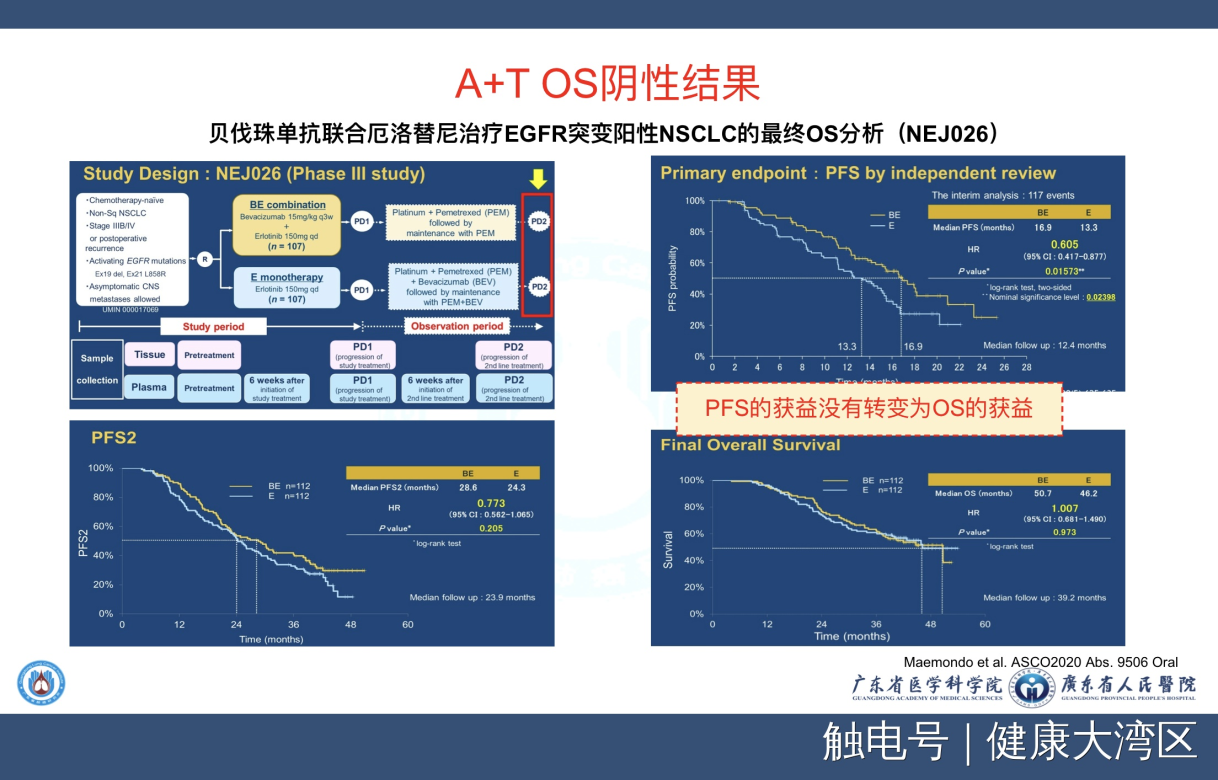
第三个研究,今年大家非常看好的所谓把抗血管生成跟靶向治疗联合起来,我们称为A加T的研究。这个A加T的研究今年报道的结果与之前的同类研究一样,PFS是非常好,可以达到16.9个月,但是最后的生存结果是没有出现差异。因此有人就说所有的研究都是在这样,。前面PFS有差异,后面的OS没有这个差异。
前几天我们跟日本的PI也做了一个中日网上直播会议,在讨论的时候我也问日本专家。我问他如何去理解没有OS的差异?他也说了这么一段话,我觉得非常有意思的,他告诉我他说今天我们所有靶向药物后续的治疗越来越多越来越有效,我们从一代到二代到三代,然后有cMET,还有越来越多越来越多的药物,因此他认为现在在日本凡是做EGFR突变甚至ALK,要看到总生存差异基本是做不到的。
我们大家知道日本是全世界所有的临床研究总生存最长的,所以他认为OS差异永远做不到,他认为我们看前面这PFS就已经足够来看药物它效果,我觉得他的观点跟我刚才给大家表达的辅助治疗的观点非常的相似相近,我们看前面PFS这段时间,你们看看它的OS达到了50个月,而前面才有16.9个月,50个月减十几个月,还有三十几个月,在后面的情况那么复杂,你看看这个OS怎么会做出差异?是做不出来的。这个观点我是认同的,就是这样的道理。
我们看看亚组分析,同样是这样的道理,我们特别关注的21外显子突变,21外显子突变也没有做出差别,但是请你们看到21外显子突变在这个研究里面达到了50个月,而19外显子突变只有41.9个月,我们过去的观点总认为19突变应该活得更长更长的,但是加上抗血管生成药物之后,21外显子突变的PFS超过了19外显子突变,所以再一次证实了A加T这种模式对于21外显子突变是一个非常好的一个选择。

我们把第二部分做一个小结,这三个研究给我们的提示。这个提示就是一代加三代,它最关键问题是把我们两个原来的短处给弥补了,所以是新的治理模式,是克服耐药的一个全新的尝试。
第二个TKI联合SBRT达到20个月PFS,PFS也延长了,但是这个OS并不十分令人的满意,所以值得我们进一步探索。
第三个我们也看到了A加T模式的总生存,达到了50.7个月,但是实际上没有OS获益,所以今天我们对联合治疗得出的结论,也就是说我们现在大部分研究仍然在改善前面的PFS,而不是在改善OS,跟对照组比较。但是总体而言,EGFR突变的病人用上TKI它的总生存都是得到了延长,只不过是说跟用药的先后模式比较起来,没有差别而已。

第三个部分我们就来看看关于罕见突变。对于罕见突变我们把这个图表示出来,这个图是什么呢?就是目前中国已经批准上市的药物列表 ,图里面用黑色表示是中国已经有药的,红色的话是美国FDA跟欧洲或者日本已经批准了,中国是没有药的,绿色的话是中国已经有上市药物,但不是批准在肺癌的。
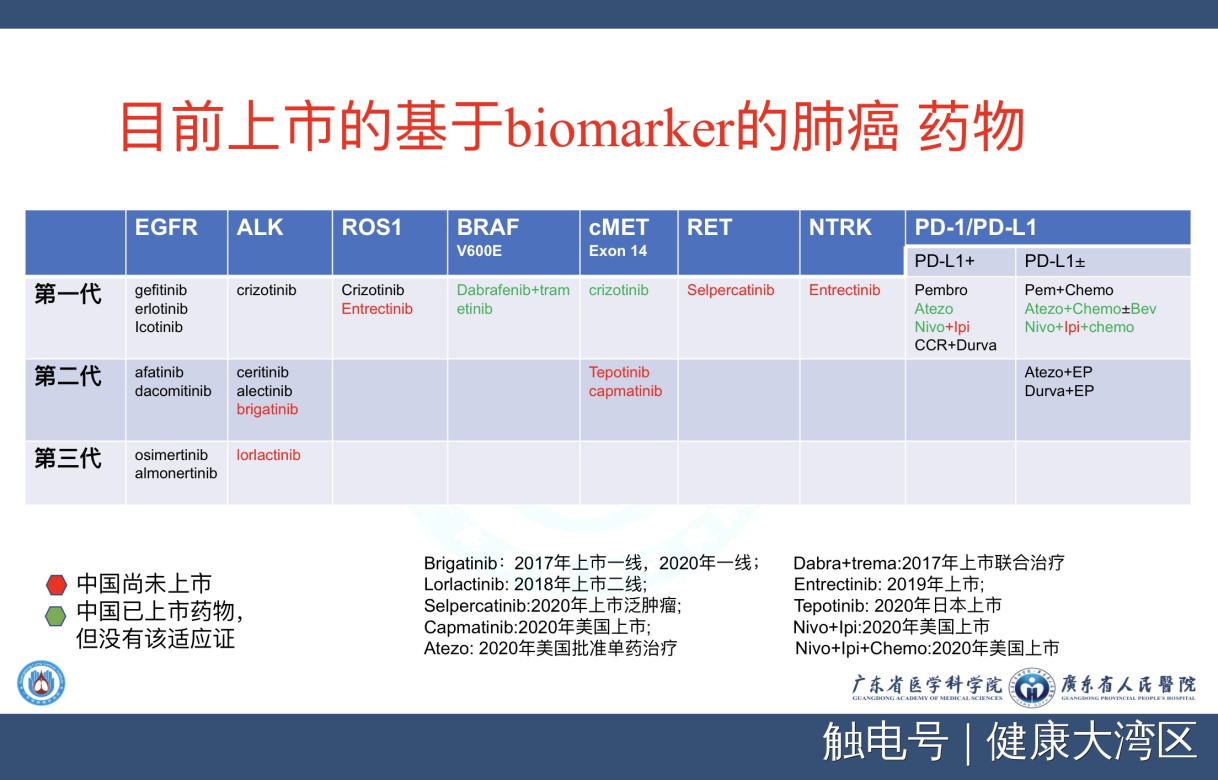
总体一个印象,我们看到了所谓中国能够用的药大部分都集中在EGFR、ALK、ROS1这些常见的突变,对后面的这些非常罕见的病人,全世界已经在用的药,我们中国基本上还没办法可及,这是中国目前的一个实际情况。

我们来看看ROS1新出现了一个药,这个Entrectinib是去年上市的药。我们看到了今天赖以批准的临床试验,它的例数都非常少,只有51例。51例RR达到73%。我们非常清楚,凡是靶向药物它的有效率能够超过50%的,这个药物肯定是成立的,因为它超过了传统的化疗,所以这是一个用50例来批准的这么一个药物。

另外我们看BRAF基因,是两个药的联用。我们看到,两药的也只有36例,非常少,单药的是78例,两个药在初治的病人有效率是58%,单药是26%,而58%的有效率跟前面已经治疗过的二线60%的有效率,同样超过了我们的标杆50%以上,所以这个BRAF突变应该认定的标准药物治疗方案是两药的联合,这是第二个少见突变的治疗。
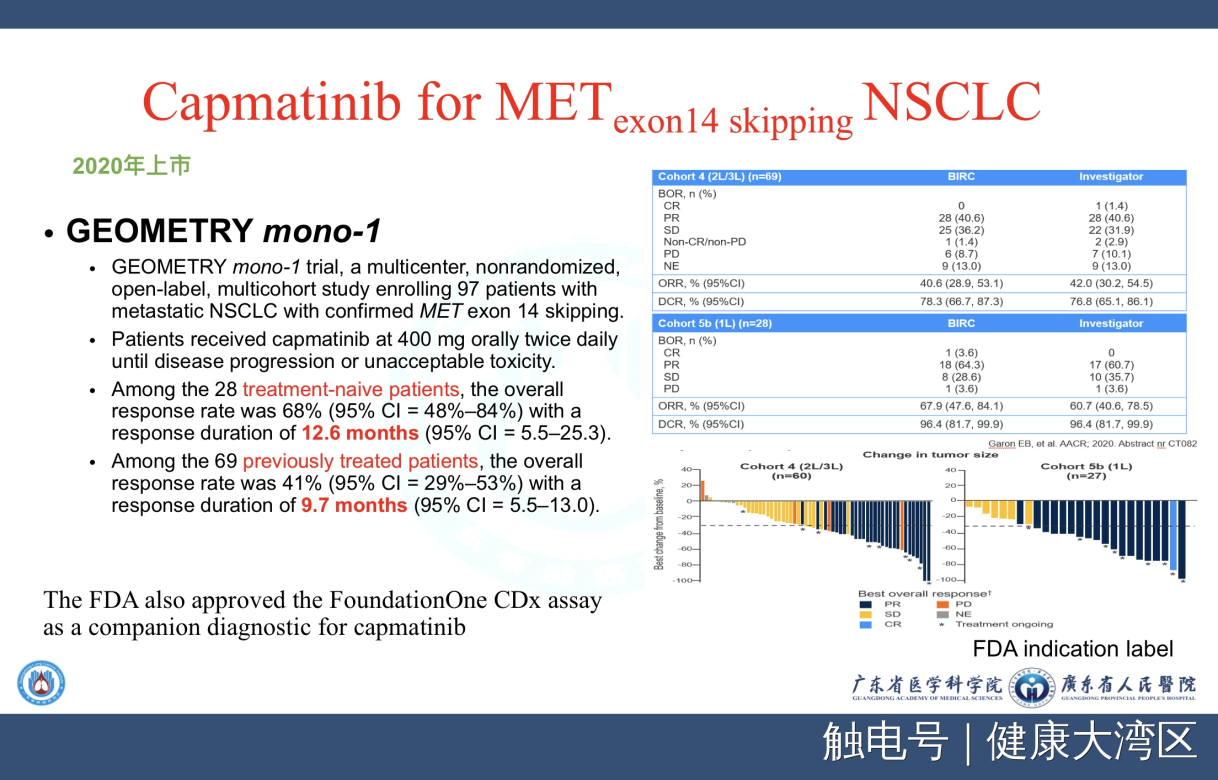
第三个就是Capmatinib,另外名字是INC280。我记得2010年的时候,诺华公司第一次INC280中国发展会,我是跟张力教授去参加的。Capmatinib在2020年FDA批准上市,你们看到的结果体现在MET基因14外显子跳跃突变。我们可以看到,28例初治患者RR达到68%,69例经过前期治疗的患者,RR 仍有41%,依据这个今年美国FDA批准INC280上市治疗MET14外显子突变,诺华的。

日本根据另外一个非常少数的研究,99例,批准Tepotinib治疗MET基因14外显子跳跃突变,疾病控制率56.7%,超过50%,这也是一个单臂研究,对于罕见的突变,我们所看到的就是这样的情况。
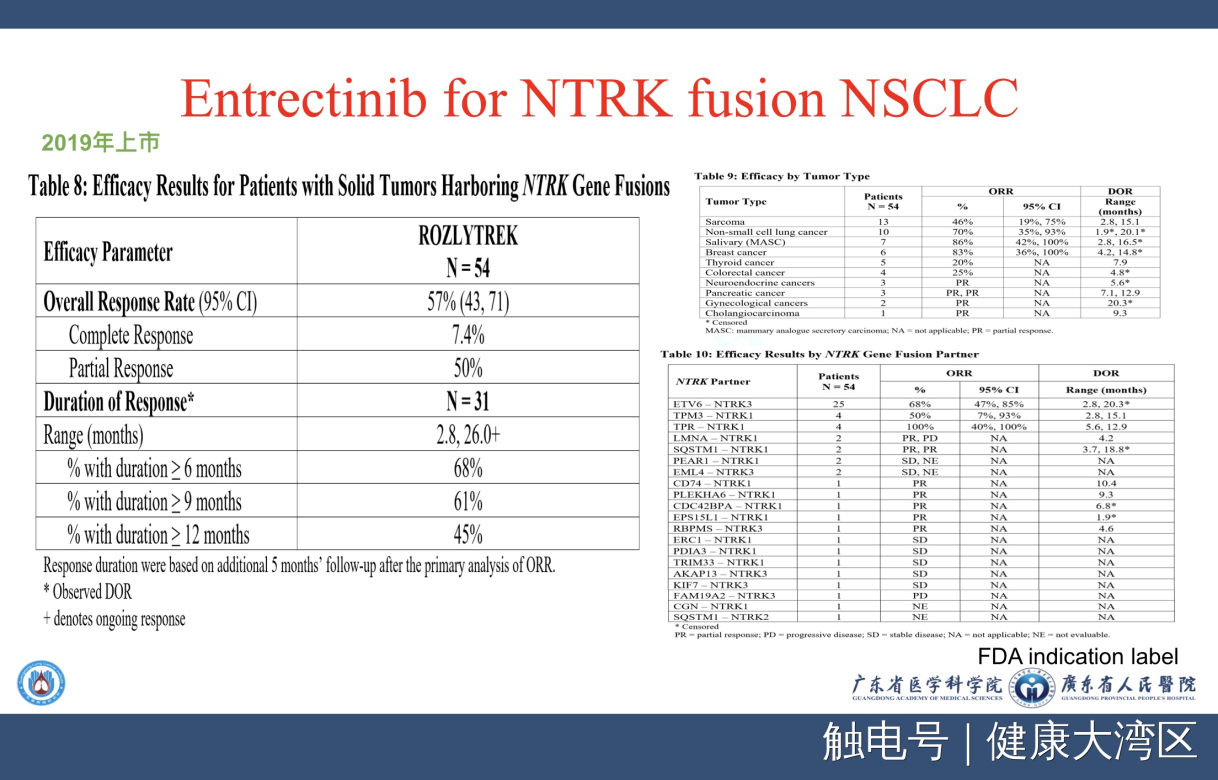
我们再来看看还有一个非常有意思的NTRK融合突变的药物,这一个突变在儿童肿瘤特别多见,也是一个泛肿瘤的突变,其中用在肺癌的例数实际上并不是很多,所有肿瘤是54例,但是其中非小细胞肺癌只有多少例?只有10例,非常少的病例。它总体的有效率加起来达到了57%,而单纯肺癌可以达到70%,所以也得到批准。这种非常少见的一些突变病例,用于研究的例数都不是特别多,但是可以用来批准上市的药物。
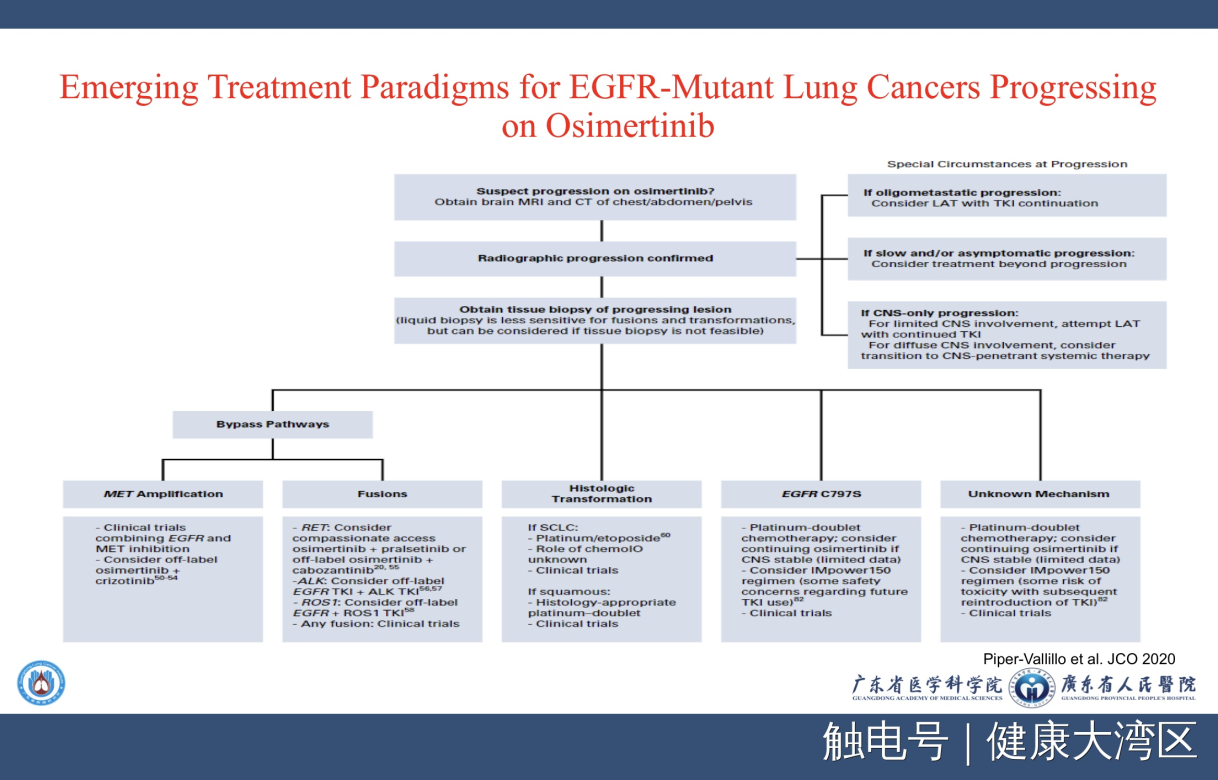
有了这些药物之后,对我们今天的影响是什么?这是刚刚发表在JCO一篇非常好的一篇综述。这篇综述讲什么?专门讲奥希替尼耐药之后我们如何处理的一些观点,它有意思的在什么地方呢?在影像学出现进展的时候的处理原则,完全符合由我们肺癌研究所提出来的三种进展模式,局部进展,孤立性进展,还有快速进展,它沿袭了这样的一个情况。
下面的问题是什么?就是通过基因检测来发现它新的耐药机制,新的耐药机制包括了MET的扩增,包括了融合,ROS1的融合,ALK的融合,还有小细胞肺癌的转换,还有T790M突变。我们不要把它看得那么复杂,共性在什么地方?共性在凡是出现有相应的带有一定驱动基因突变的耐药,这篇综述主张两个药的联合,继续使用原来的EGFR TKI,加上抑制这一个新的突变的药物,比如说我们可以加上MET的抑制剂,RET的话加上RET的抑制剂,ALK加上ALK的抑制剂,可以这样做,还有就是参加临床试验。
而对于小细胞肺癌转化,今天我们没有很多的方法,大家可以试用什么呢?还是回到化疗,然后在某些特定的情况下,可以考虑IO免疫治疗。然后T790M,就是刚才提到了一代加三代化疗等等。
在这篇综述里,实际上非常清楚地告诉我们未来的路子该如何走。当我们有了新的检测方法,发现越来越多的这种基因的融合突变的时候,是主张两条通路一起来抑制这么一种治疗模式,这是有意思的。

把这些发现运用到我们临床实践,出现了一个什么情况?那就是在今年的中国肺癌高峰论坛,我们提的第一个共识。现在的许多临床医生还是比较喜欢先检测EGFR,或者说ALK,或者是前面三个阴性了,我们才一个一个往后推。但是肺癌现在有靶点的药至少有七个,估计今年到明年还有两到三个新靶点的药物会批准上市,也就是说今年到明年至少有十个基因我们临床需要知道的、有用的。
在这种情况之下,我们再来说one by one,一个检测过再测另一个是不对的。,所以我们提出的共识是要采用高通量的检测方法,一次性的把这些基因检测出来,更何况我们还可能要看共突变,我们还要看这些耐药之后,它伴随着什么样的一个耐药机制,所以现在我们认为高通量的检测方法应该提到我们的议事日程,我们不能够再像过去的一个一个这么来检测,这是我们的共识。
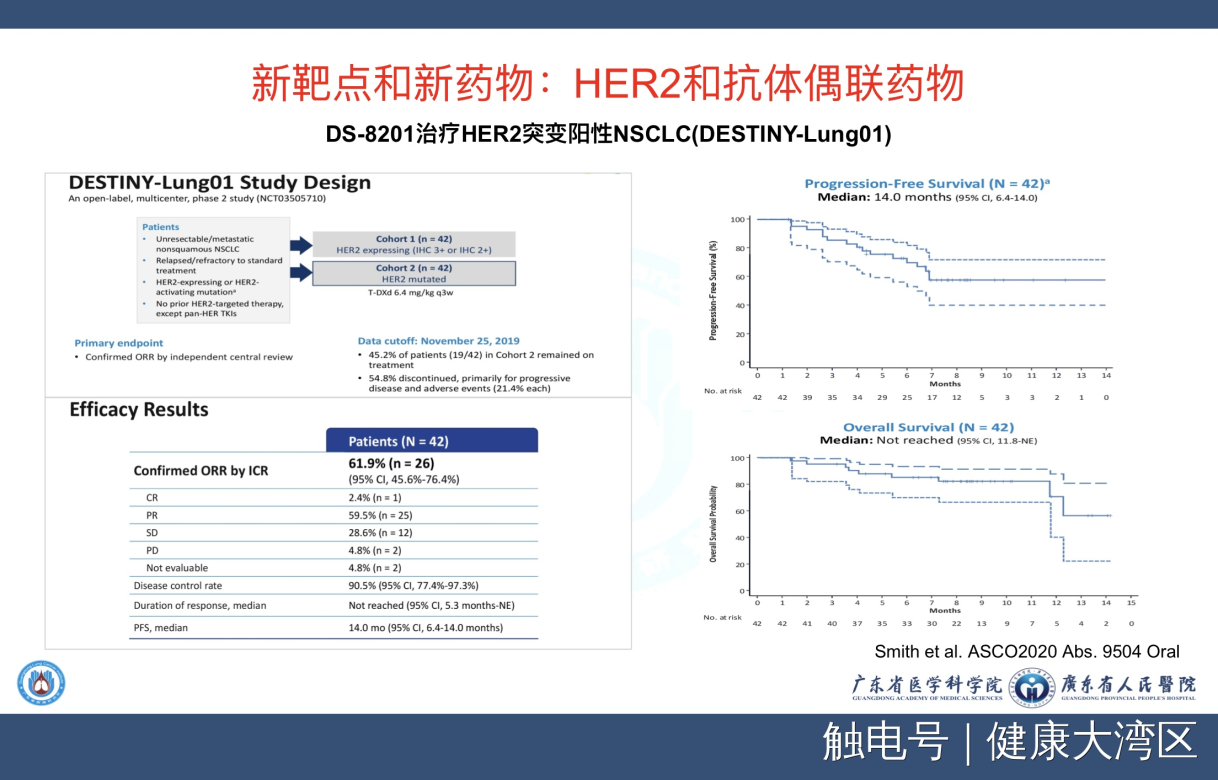
第二个问题就是我们要看看未来非常短的时间,会出现什么状况?第一点,我们看这个HER2,这是一个非常有意思的乳腺癌靶点,今天在肺癌,我们发现它的发生率也可以达到1—3%左右,而且新出现的一类药物是抗体的偶联药物,抗体偶联药物就是一个抗体来定点肿瘤的位置,联合上一个细胞毒的药物。
偶联药物在乳腺癌取得比较多的成功,在其他肿瘤,在肺癌基本上没有取得成功。今年我们看到了这个HER2抗体偶联药物,结果非常的令人兴奋。我们看到,无进展生存14个月,OS到现在还没有达到,这代表着未来一个方向,就是抗体偶联药物可能会用于肺癌的新靶点,只要有一个抗体的偶联药物在肺癌取得突破,后面就源源不断有新的药物出来。我觉得这是一个非常令人高兴的未来的一个发展。
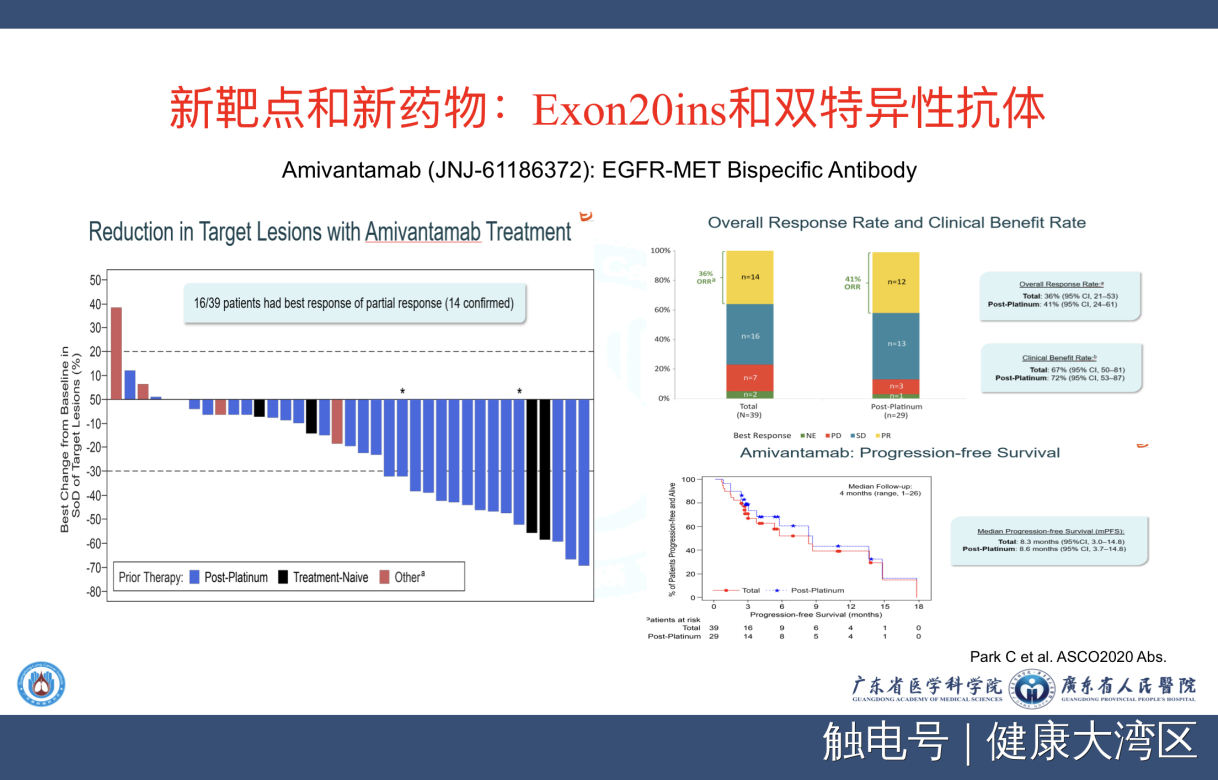
我们看看另外一个新的靶点,新的药物是双特异性抗体,我们刚才讲是偶联抗体,这是双特异性抗体,而双特异性抗体最有代表性的就是强生专门针对20外显子插入突变,我们看到这个瀑布图也是非常的令人兴奋的,总的有效率也非常好。这个双特异抗体原来设计的是阻断EGFR跟c-MET的通路,因为cMET靶点非常重要。但首先的发现却在20外显子的插入突变上,有非常好的作用,这个研究现在也取得了美国FDA的快速审评。我们相信,只要这个研究的病例数达到一定量之后,FDA也很快会批出来。我最近刚刚得到的信息是,20外显子这个试验已经完成了入组,已经快递交上市的申请了,这是新的靶点。

我们来看看在目前的20外显子插入突变,我们做了非常多的研究,我这里特别提到了poziotinib,这个最早用在20外显子插入突变的,在韩国研发的一个药物,但是非常遗憾,今年2020报道的最新有效率,从原来百分之八十几降到了百分之十几。韩国本来已经在中国取得了做临床试验的批文,但是现在看到结果,韩国宣布放弃这个药不再做了。实际上我们可以看到,在早期取得成功的药在后面不一定能够取得成功。TAK-788临床试验现在也在进行中,很快会有结果出来,我们刚刚开始了它新的三期头对头的对照研究。

还有一个抗体,原来我们常用的CEA标志物,我们一直用来检测几十年了,从来没有与药物研发。今天有一个药专门针对CEACAM5,是CEA的亚型,在CEACAM5这个靶点上,用抗体偶联药物来靶向它,这个研究最大的出彩在于把PD-1、PD-L1治疗失败的病人,用这个药来做二线的治疗,看看效果。这一个临床试验中国目前跟全球处于同步开发之中,这是新的靶点。

我们再看看MET扩增。MET扩增用靶向药物的话就是这个结果,这个结果到今天为止似乎还不是令人高兴。
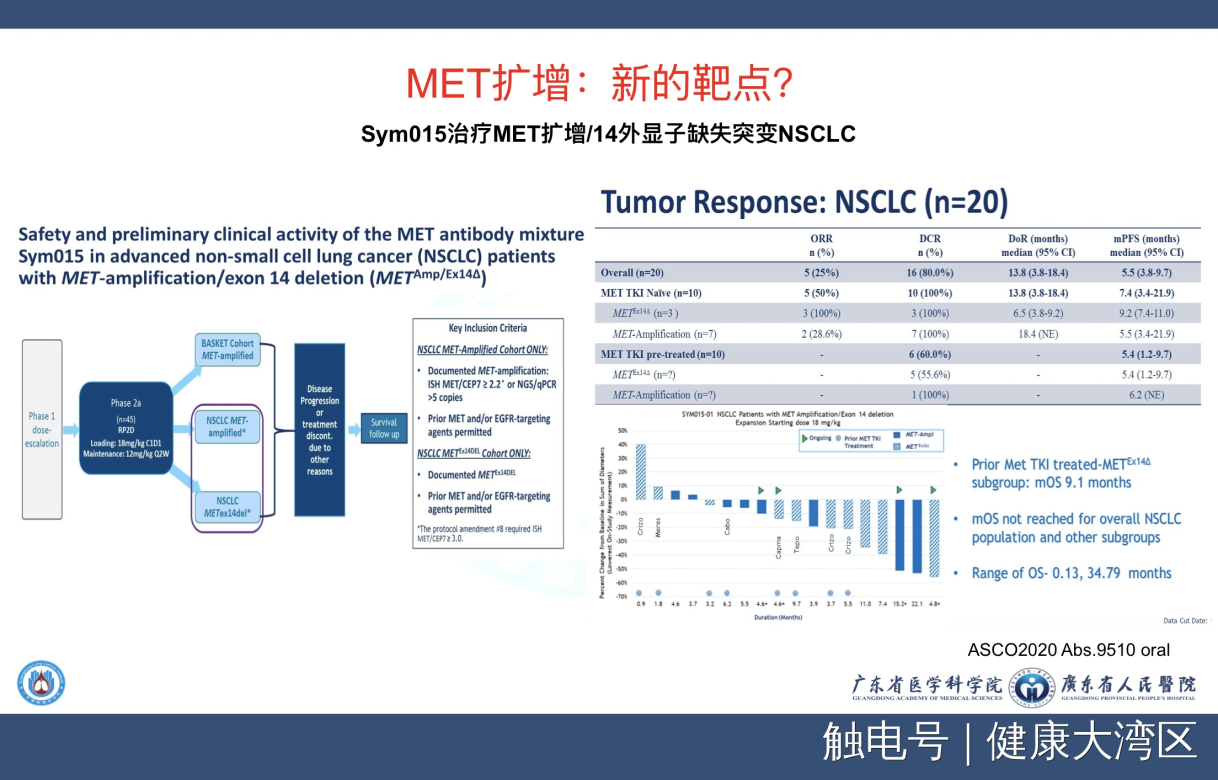
我们看到了另外一个新的抗体偶联药物也在用于MET扩增。
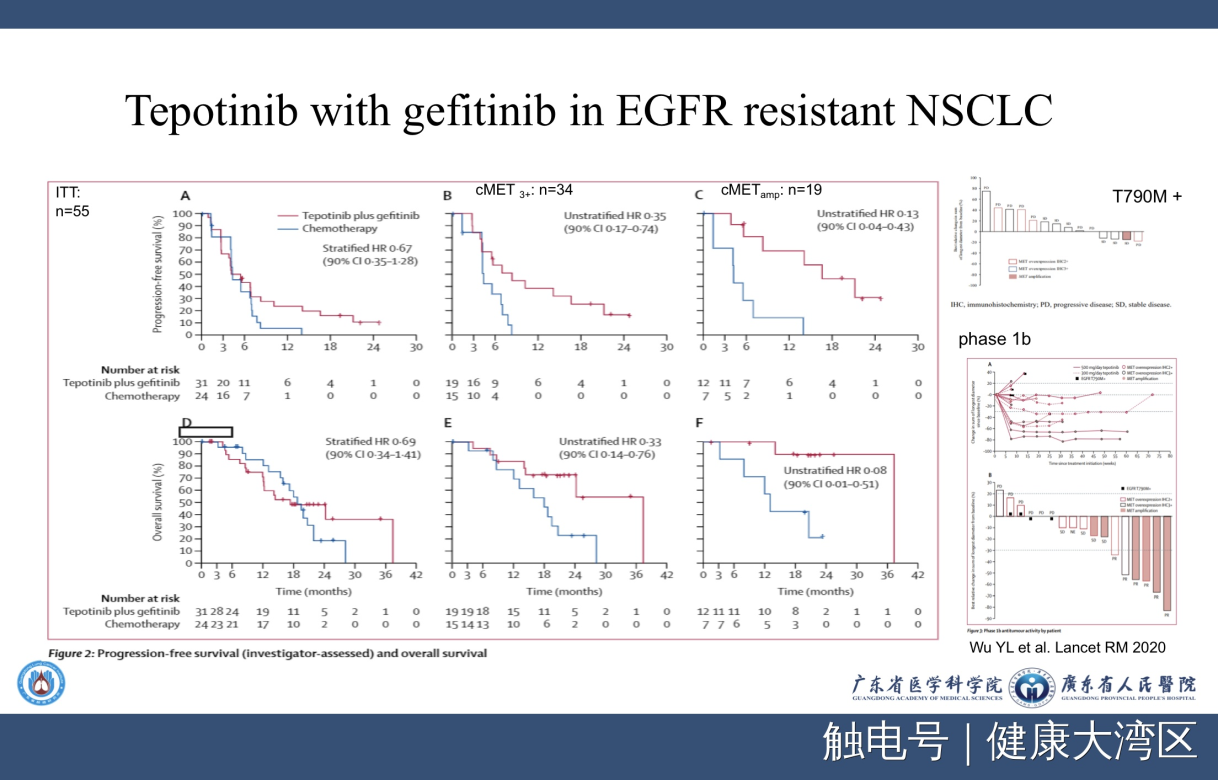
最后是我们做的工作,发表在LANCET子刊上,就是Tepotinib加上gefitinib克服EGFR的耐药机制。如果copy number大于5,效果是非常令人满意的。所以这也是未来非常有希望的一个方向。

最后给大家做个总结,今天的小结有三方面:我们可以看到靶向药物现在已经从晚期走向了早期;一个新的联合治疗突破了我们原来的思维,我们现在应该根据它的机制,可以把很多老药放到一起设计出新的试验。新靶点新药物,我用一个词叫做层出不穷,确确实实是这个世界变化得非常非常快,这是我今天演讲的。

最后做个广告,今年9月份的世界肺癌大会因疫情的关系,我们把它拆成两个,一个是8月8日的虚拟大会,在这个大会上,张力要代表我们中国做一个大会的口头发言,免疫联合治疗的。明年1月的世界肺癌全体大会,这两天也做出了最后的决定,把它改成线上的会议,不能开线下会议,这个疫情已影响到明年,我们还是这样的,可能这个线上会议都变成常态了。
谢谢大家!

吴一龙教授于2020年7月17日在广州举行的第十四届“中国临床肿瘤学会(CSCO)-南方肿瘤高峰论坛暨番禺肿瘤论坛”上分享上述学术报告。识别上图二维码可以收看本次大会全部直播和新闻报道。大会由广州抗癌协会(GACA)和中国临床肿瘤学会(CSCO)联合主办。广州中医药大学金沙洲医院、广州市番禺中心医院、广东省人民医院、南方医科大学南方医院联合承办。围绕“肿瘤精准医学与个体化诊疗”主题,聚焦肿瘤生物治疗与免疫治疗、精准医学与个体化治疗、精准放疗、肿瘤外科治疗、肿瘤药物治疗、常见肿瘤的综合治疗等多个专题。

大会名誉主席、中科院院士姚开泰(左二)
大会名医荟萃。中国著名肿瘤病理生理学家、中国鼻咽癌研究奠基者、90岁高龄的中国科学院院士姚开泰担任大会名誉主席,吴一龙、徐瑞华、林丽珠、马骏、刘继红等国际、国内肿瘤界知名专家担任论坛主讲嘉宾或主持嘉宾。与会专家的精彩演讲,全面传递了当前肿瘤学的新概念、新进展,涵盖了肿瘤基础研究、肿瘤外科、肿瘤生物与免疫治疗等内容。

大会主席、中山大学肿瘤医院院长徐瑞华教授
中山大学肿瘤医院院长徐瑞华分享大肠癌国际研究新进展——肿瘤名家讲坛(一)点击蓝字标题收看徐瑞华院长学术报告)

广中医一院副院长林丽珠
广中医一附院副院长林丽珠分享中医药在肺癌治疗的应用价值——肿瘤名家讲坛(二)点击蓝字标题收看林丽珠副院长学术报告)
