翘首期盼了近4年,终于等到研究成果了。
近日,四川大学华西医院卢铀教授团队在顶级期刊《自然·医学》上发布最新研究成果[1]:使用CRISPR-Cas9编辑的T细胞在临床上治疗疾病是安全可行的。
这项研究成果再次证实了CRISPR基因编辑技术在临床应用中的安全性,为后续类似研究的开展奠定了基础。

▲ 论文首页截图
卢铀教授团队发起的这项基因编辑临床研究,其实是世界第一个CRISPR疗法人体试验,开始于2016年6月。
当时的情况是,大量的基础研究证实,CRISPR-Cas9是一种方便、灵活、精确的基因编辑方法。但是CRISPR-Cas9在临床应用中的安全性还需临床研究检验。
在CRISPR-Cas9基因编辑技术冉冉升起的时候,癌症免疫疗法也在蓬勃发展。阻断PD-1/PD-L1通路的PD-1抑制剂,已经成为PD-L1表达阳性的晚期非小细胞肺癌(NSCLC)的一线治疗药物。这一疗法甚至能将患者的5年生存率提高到15.5%-23%[2]。
免疫疗法的成功,让卢铀教授团队想到:破坏T细胞的PD-1,然后将T细胞回输给患者,对于晚期肺癌的治疗可能也是有效的。
这个猜想一方面是基于免疫治疗的基本逻辑,另一方面是基于当时已经存在的两个基础研究:用锌指编辑技术编辑T细胞的PD-1,可以增强T细胞对黑色素瘤细胞的毒性[3];以及用CRISPR-Cas9破坏T细胞的PD-1,可在模式小鼠身上对抗胃癌[4]。
T细胞和肿瘤细胞之间的PD-1/PD-L1通路
基于以上的研究成果,卢铀教授团队在晚期肺癌患者中,开展了临床研究。由于是首个人体临床试验,考虑到伦理学问题和脱靶突变的风险,他们在剂量递增的I期临床试验中,只招募那些经过多种疗法治疗之后依然无效的NSCLC患者。
在2016年8月26日到2018年3月21日之间,一共招募了22名患者。研究人员从患者体内采集T细胞,然后用电穿孔的方法将CRISPR-Cas9编辑系统转入T细胞中[5],破坏PD-1基因的2号外显子。
总体来看,基因编辑的效率在8.7%到31.2%之间,中值是20.1%。在编辑过的T细胞中,PD-1的表达水平明显降低,PD-1的破坏率在33.7%到67%之间,中值是46.3%。
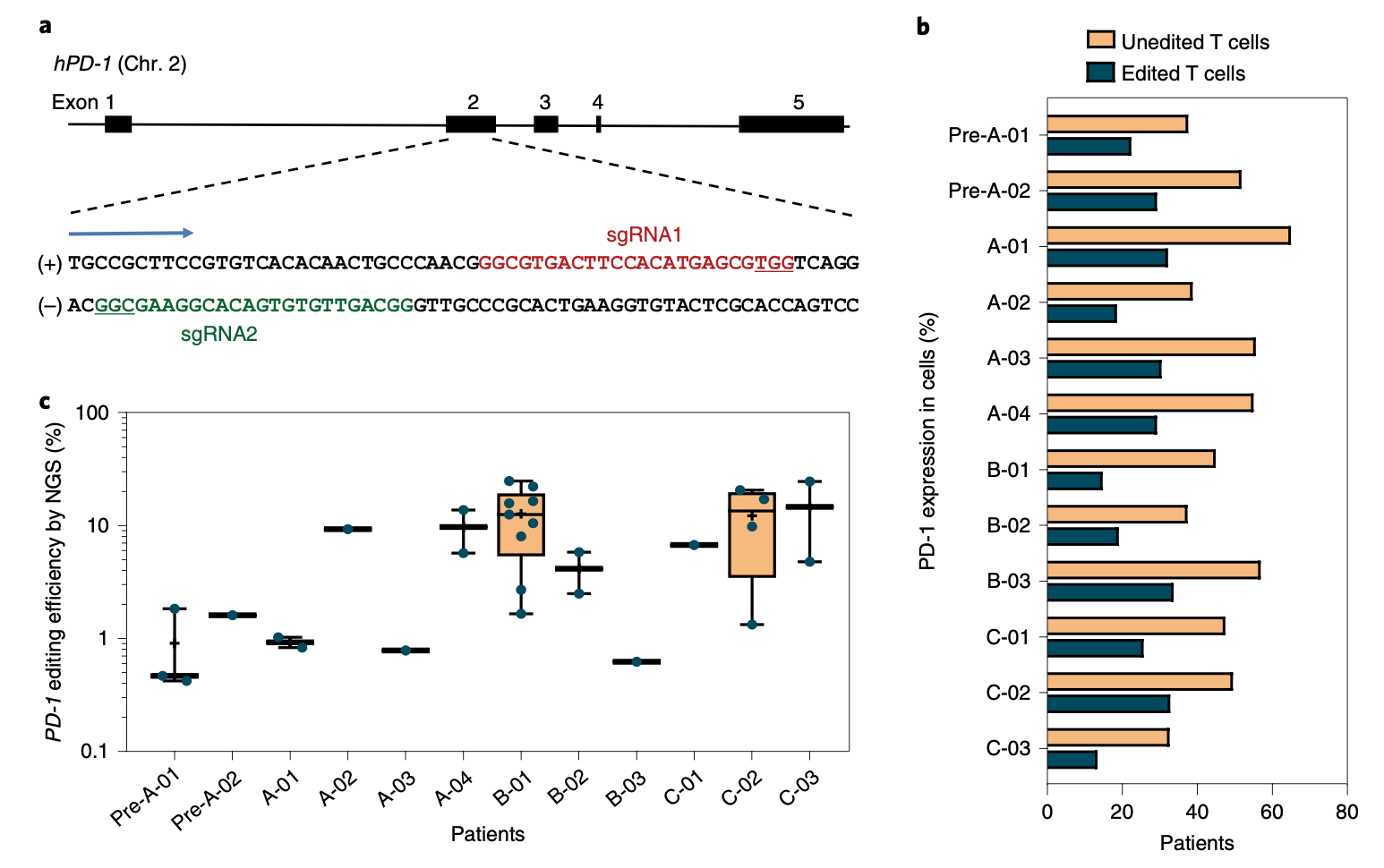
基因编辑T细胞的机制,及编辑效果
在招募的22名患者中,有5名患者因T细胞体外扩增不足,没有接受治疗,余下的17名患者均获得了高活性(90%)的编辑后的T细胞。制备T细胞的中位时间是25天(17-40天)。
只不过,在回输编辑过的T细胞之前,有2人疾病进展,1人肺部感染,1人类风湿关节炎加重,1人主动退出研究。最终有12人接受了T细胞的回输治疗。
接受治疗的患者以28天为一个周期,分三次注射PD-1被编辑过的T细胞,直到患者疾病进展或者出现不能耐受的毒性为止,每位患者每次回输T细胞的中位数是1.33亿个。
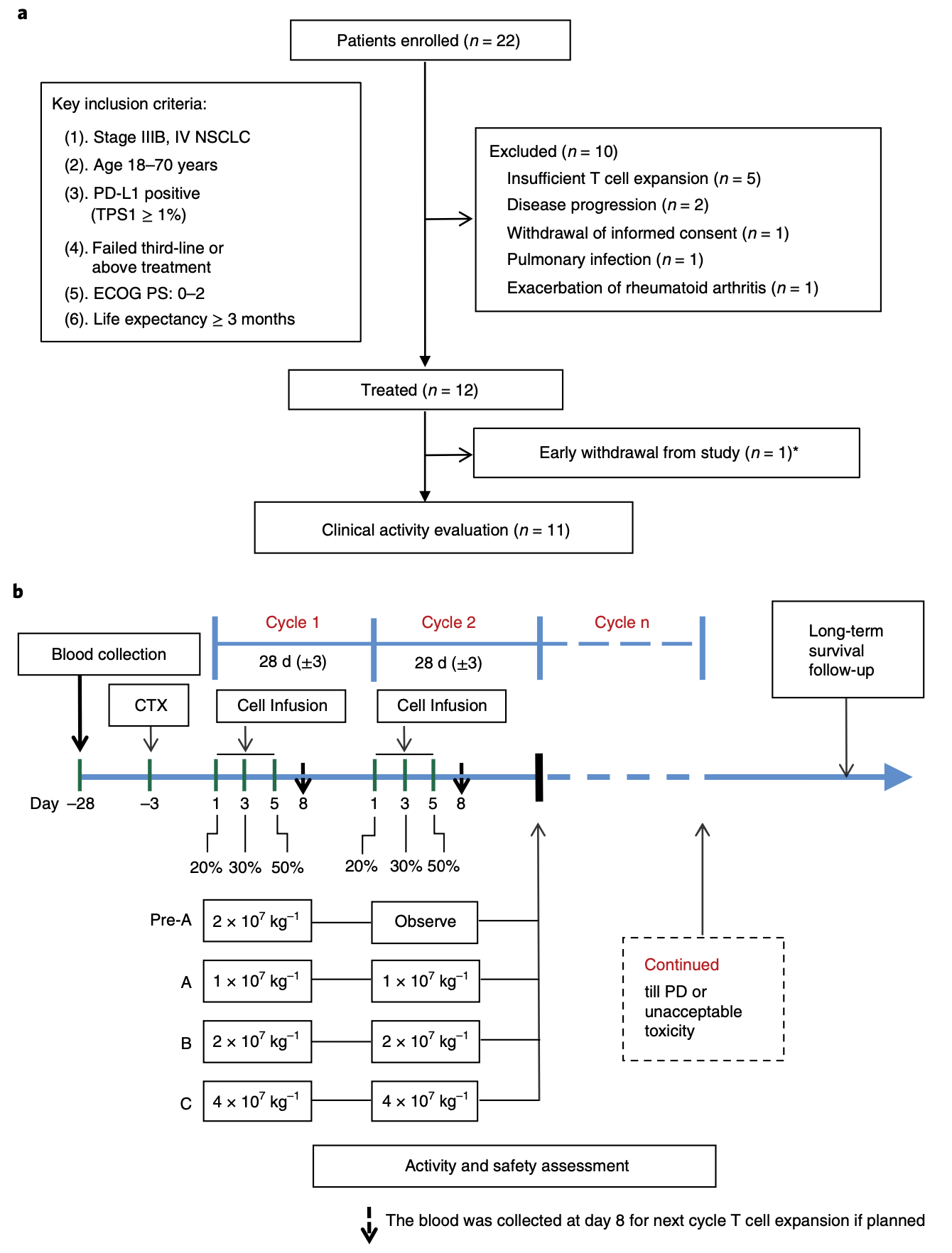
试验设计流程
从12位接受治疗的患者来看,他们的T细胞中位编辑效率是5.81%。在所有被编辑的T细胞中。绝大部分是CD3阳性(中值99.1%),CD3和CD8双阳性占比73.5%。
与未被编辑的T细胞相比,在被编辑过的T细胞中,CD8和IFN-γ双阳性的占比显著增加。这表明,破坏T细胞的PD-1之后,T细胞的活性增强了。
至于大家最关心的编辑脱靶率,研究人员也做了深入的研究。总体来看,中位脱靶率是0.05%,远远低于1.69%的中靶率。基于这个数据,研究人员认为,CRISPR-Cas9编辑T细胞是安全的。
具体来看,在主要的脱靶导致的突变中,会导致移码变异的插入/缺失占比71.2%,不会导致移码的插入/缺失占比28.6%,其他类型变异极少。还有一点值得一提的是,这些突变主要出现在基因之间(48.1%)或者内含子(35.1%)区域,对基因功能的影响不大。
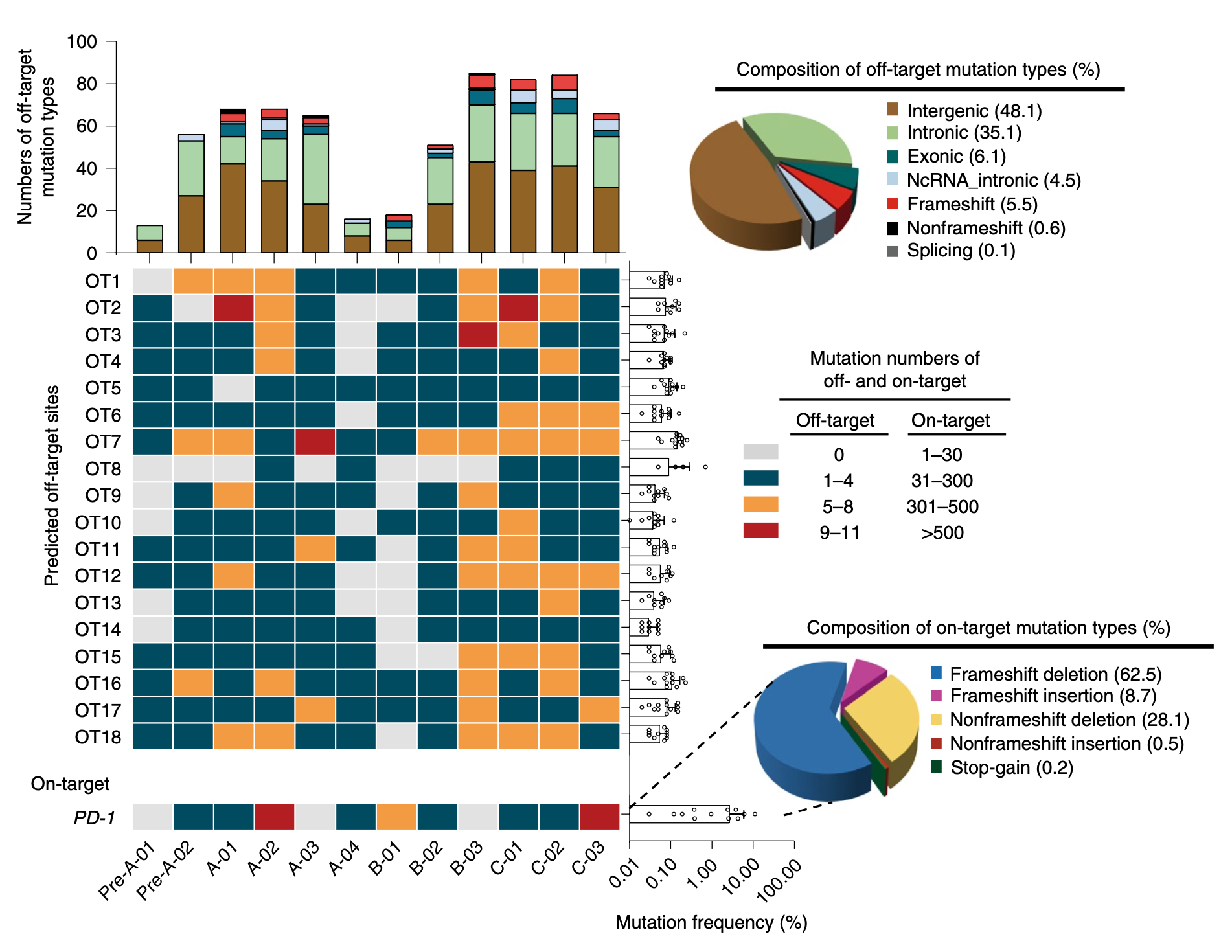
脱靶的情况分析
从安全性上来看,在12名接受治疗的患者中,有1名患者没有出现治疗相关不良事件,其余11名患者发生了1/2级与治疗相关的不良事件,例如淋巴细胞减少症(3例)、疲劳(3例)、白细胞减少症(2例)、发烧(2例)、关节痛(2例)和皮疹(2例)。
这就意味着没有患者出现3级及以上的不良事件,而且没有患者出现细胞因子释放综合征。也就是说,CRISPR破坏T细胞的PD-1,作为一种治疗策略是安全的。
治疗相关的副作用
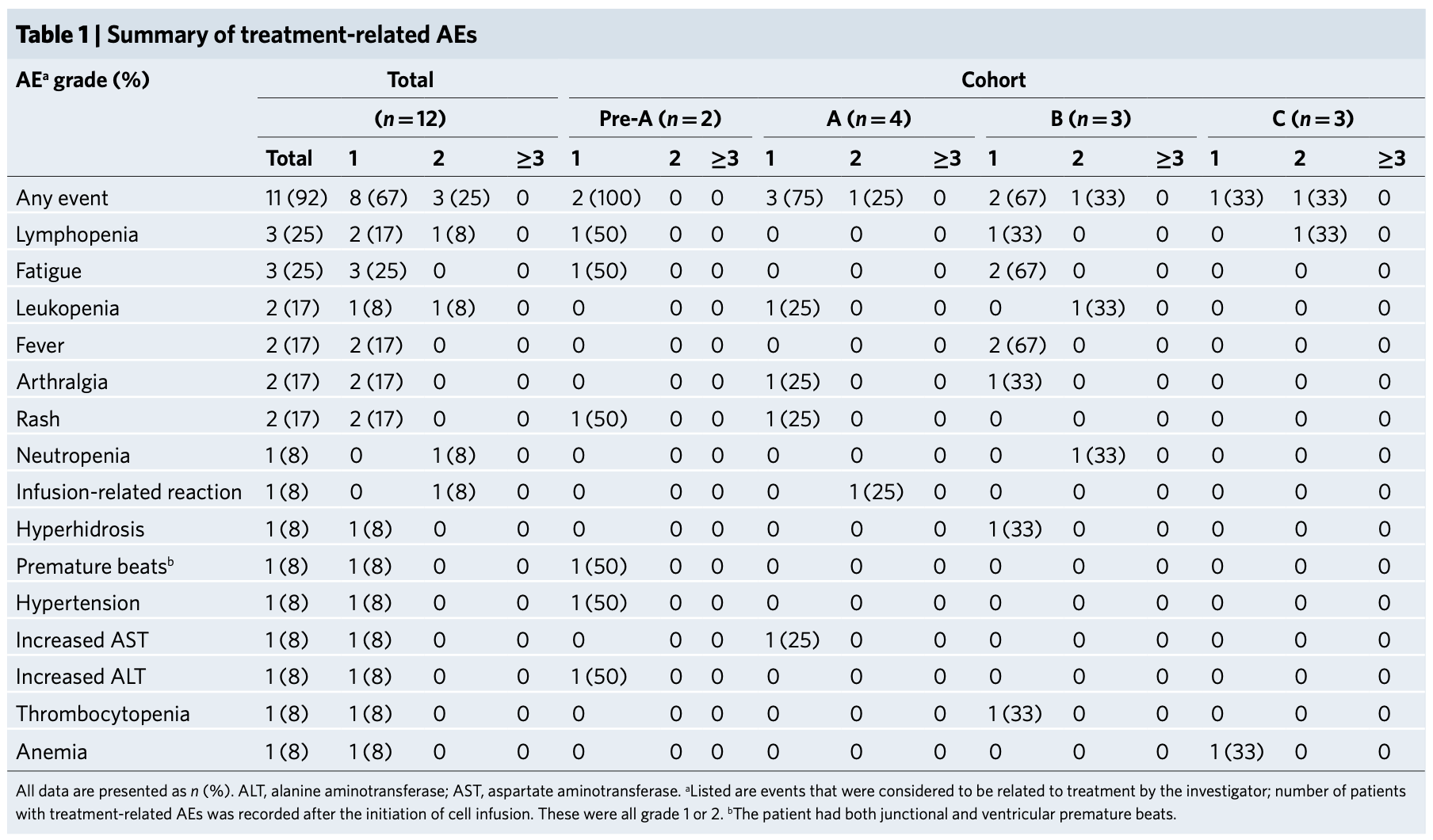
从治疗的效果上看,在长达47.1周的中位随访时间内,12名患者的中位无进展生存期(PFS)是7.7周,中位总生存期(OS)为42.6周。不过没有患者获得部分缓解,只有两名患者病情稳定。
截至2020年1月31日,所有患者出现疾病进展。在12名患者中,有11名(91.7%)死于肿瘤进展,所有患者的死亡均与治疗无关。剩下的一名患者仍在接受其他治疗。
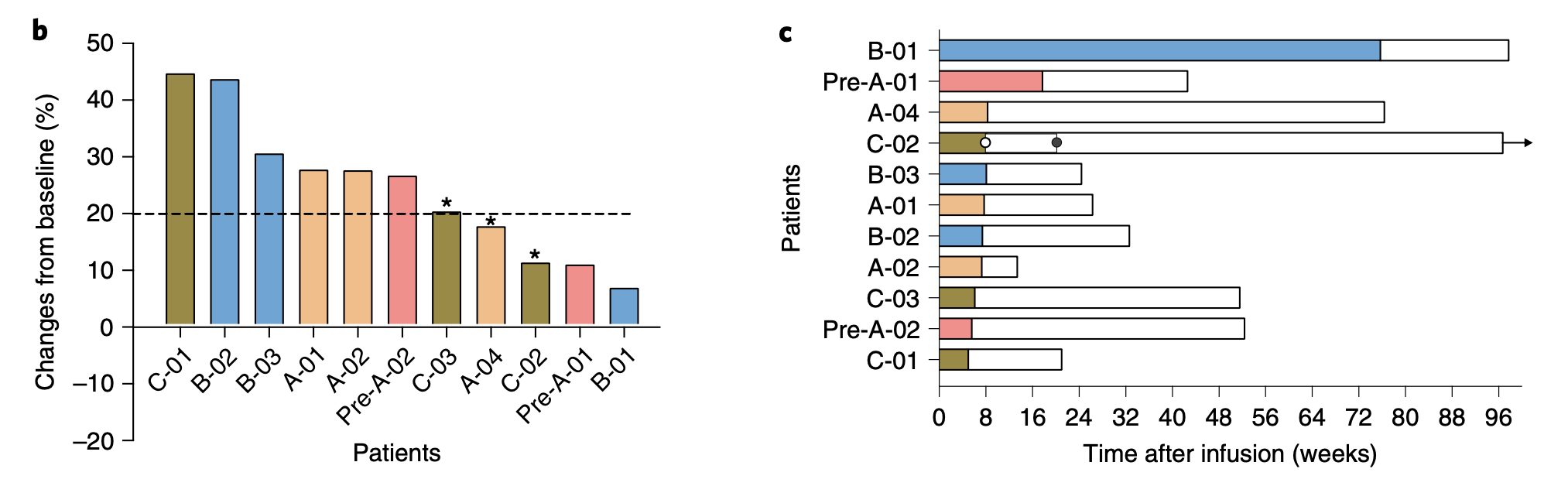
患者的治疗情况
基于以上数据,研究人员认为,他们的研究成果进一步支持了由CRISPR-Cas9技术进行的基因编辑T细胞疗法在临床上的安全性和可行性,这也与Carl June团队近期发表的结果一致[6]。
至于大家担心的脱靶效应,一是脱靶率低,二是绝大多数发生在非编码区,这不太可能对编码基因产生重大影响。
虽然CRISPR-Cas9技术的临床使用的长期安全性仍然需要关注,但是在本研究中,他们发现被编辑的T细胞寿命较短,因此他们认为永久性基因组改变的风险是有限的。
参考文献
[1].https://www.nature.com/articles/s41591-020-0840-5
[2].Garon E B, Hellmann M D, Rizvi N A, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study[J]. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 2019, 37(28): 2518-2527.
[3].Beane J D, Lee G, Zheng Z, et al. Clinical scale zinc finger nuclease-mediated gene editing of PD-1 in tumor infiltrating lymphocytes for the treatment of metastatic melanoma[J]. Molecular Therapy, 2015, 23(8): 1380-1390.
[4].Su S, Zou Z, Chen F, et al. CRISPR-Cas9-mediated disruption of PD-1 on human T cells for adoptive cellular therapies of EBV positive gastric cancer[J]. Oncoimmunology, 2017, 6(1): e1249558.
[5].Su S, Hu B, Shao J, et al. CRISPR-Cas9 mediated efficient PD-1 disruption on human primary T cells from cancer patients[J]. Scientific reports, 2016, 6: 20070.
[6].Stadtmauer E A, Fraietta J A, Davis M M, et al. CRISPR-engineered T cells in patients with refractory cancer[J]. Science, 2020, 367(6481).
*文章来源于 奇点网,版权归原作者所有,如有侵权请联系删除