
为进一步规范新型抗肿瘤药物临床应用,国家卫生健康委组织国家卫生健康委合理用药专家委员会牵头对《新型抗肿瘤药物临床应用指导原则(2020年版)》进行修改完善,制定了《新型抗肿瘤药物临床应用指导原则(2021年版)》(以下简称:《指导原则》),并于2021年12月27日发布。
《指导原则》指出,抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿和疾病预后三大要素。抗肿瘤药物临床应用是否合理,基于以下两方面:有无抗肿瘤药物应用指征;选用的品种及给药方案是否适宜。
《指导原则》强调,抗肿瘤药物临床应用须遵循药品说明书,不能随意超适应证使用。在抗肿瘤药物临床应用中,应充分考虑抗肿瘤药物的成本—效果比,优先选择具有药物经济学评价优势证据的品种,体现患者治疗价值。
基本原则
1.病理组织学确诊后方可使用
2.靶点检测后方可使用
目前,根据是否需要做靶点检测,可以将常用的小分子靶向药物和大分子单克隆抗体类药物分为两大类(表1)。
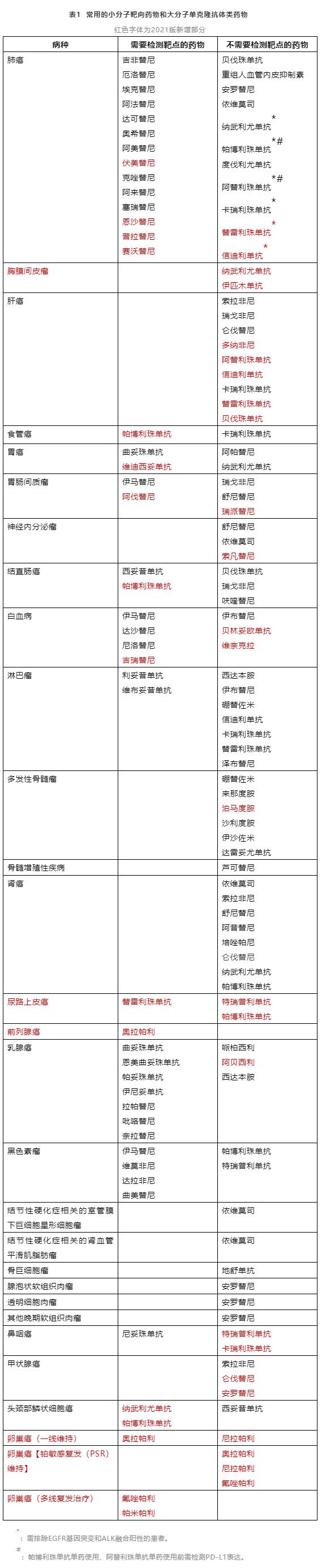
对于有明确靶点的药物,须遵循靶点检测后方可使用的原则。检测所用的仪器设备、诊断试剂和检测方法应当经过国家药品监督管理部门批准,特别是经过伴随诊断验证的方法。不得在未做相关检查的情况下盲目用药。
3.严格遵循适应证用药
在抗肿瘤药物临床应用过程中,发现新的高级别循证医学证据但药品说明书中未体现的,医疗机构和医务人员可及时向药品生产厂商反馈,建议其主动向国家药品监督管理部门申报,及时更新相应药品说明书,以保证药品说明书的科学性、权威性,有效指导临床用药。特别是有条件快速批准上市的药品,更应当保证药品说明书的时效性。
4.体现患者治疗价值
其核心思想是,在相同治疗成本前提下,使患者获得更长的生存时间和更好的生活质量。
5.特殊情况下的药物合理使用
特殊情况下抗肿瘤药物的使用权应当仅限于三级医院授权的具有高级专业技术职称的医师,充分遵循患者知情同意原则,并且应当做好用药监测和跟踪观察。
6.重视药物相关性不良反应
医疗机构应当建立药品不良反应、药品损害事件监测报告制度,并按照国家有关规定向相关部门报告。
参考来源:国家卫健委医政医管局