
EGFR-TKI在EGFR基因突变NSCLC术后辅助治疗领域已经占据了一席之地。
肺癌是一种发病率、死亡率均高的恶性肿瘤,分期为IIA、IIB、IIIA、IIIB的肺癌患者5年生存率分别约为65%、56%、41%、24%[1]。针对部分存在术后高危因素的IB期患者以及II期和IIIA期非小细胞肺癌(NSCLC)患者,辅助化疗在很长一段时间内占据着标准治疗的地位。LACE荟萃分析显示,辅助化疗将II-III期肺癌术后患者的5年生存率提高了5.4%[2],但总体情况仍不尽人意。
随着IPASS等一系列临床研究的报道,EGFR-TKI对携带EGFR基因敏感突变NSCLC患者的无进展生存期(Progression Free Survival,PFS)优势已经毋庸置疑。很长一段时间内,EGFR-TKI药物的使用局限在不可手术的晚期患者。然而,对于手术切除并合并EGFR基因突变患者,打好EGFR-TKI这张牌也非常重要,术后辅助还是复发转移后挽救?这是一个问题。
一、早期探索
早期的探索道路并不平坦。BR19研究纳入完全手术切除的IB-IIIA期NSCLC患者,不检测EGFR突变状态,1:1随机分组,接受吉非替尼或安慰剂。结果显示:无病生存(DFS)及总生存(OS)均无获益,提前结束研究(计划纳入1242例,实际入组503例)[3]。
随后发表的RADIANT研究,虽然考虑了EGFR基因状态,但采用免疫组织化学或荧光原位杂交检测EGFR的表达或扩增。研究纳入973例患者(2:1随机分组),厄洛替尼对比安慰剂,总体人群及EGFR阳性人群DFS差异均无统计学意义[4]。
二、标志性研究
转折发生在2017年,ADJUVANT(NCT01405079)研究是一项前瞻性Ⅲ期随机对照研究(图1),针对完全切除的病理Ⅱ-ⅢA 期(N1-N2)的、伴有EGFR突变的NSCLC患者,1:1随机分组,吉非替尼(111例)对比长春瑞滨联合顺铂(VP)化疗(111例)。
结果显示:吉非替尼组中位DFS 28.7个月,化疗组18.0个月,危险比(HR)=0.60,p=0.0054,达到了主要研究终点(图2)。2020年美国临床肿瘤学会(ASCO)年会更新DFS为吉非替尼组30.8个月,化疗组19.8个月,HR=0.56,p=0.001。亚组分析数据显示,N2患者从吉非替尼辅助治疗获益更多[5, 6](图3)。
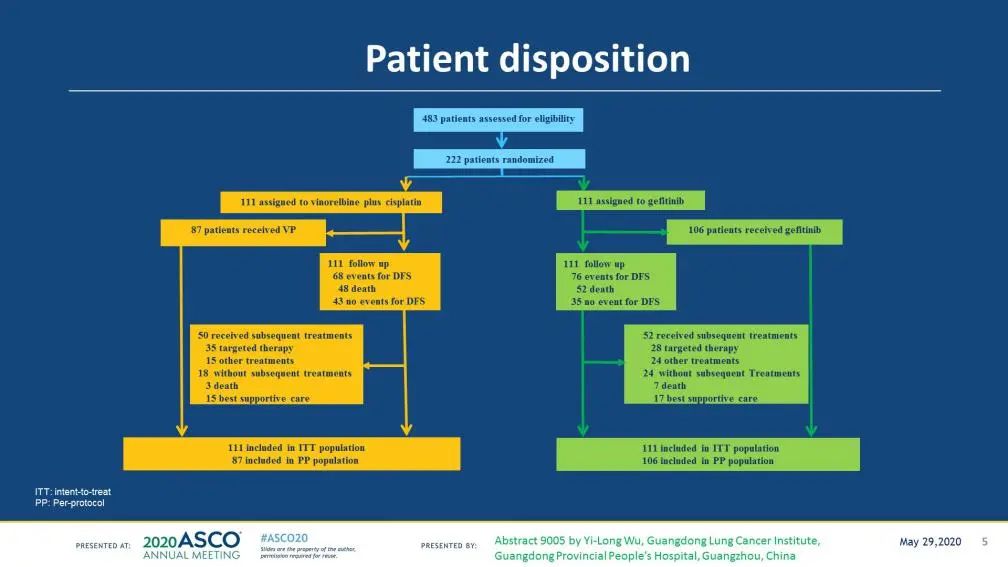
图1. ADJUVANT研究设计
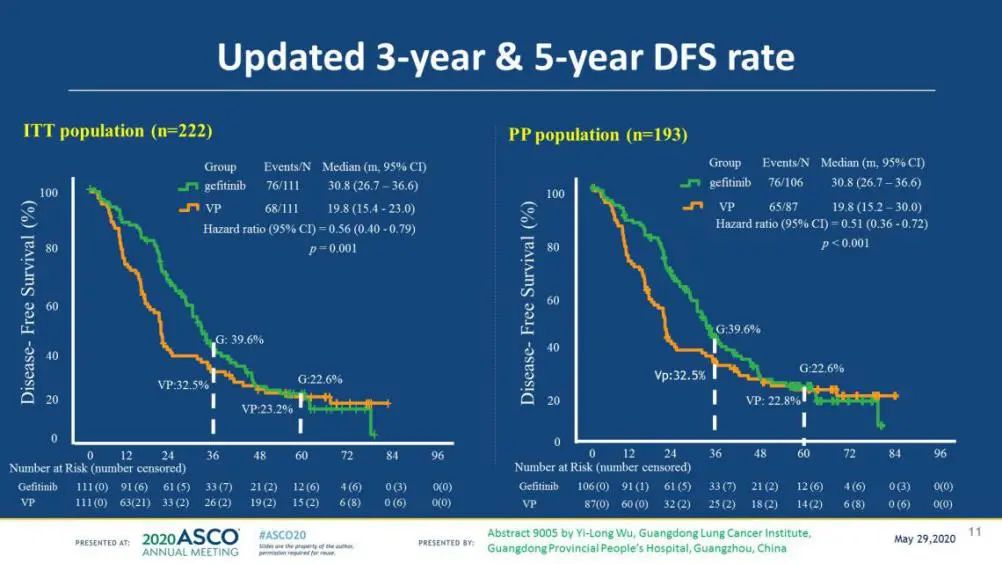
图2. ADJUVANT更新DFS(2020ASCO)
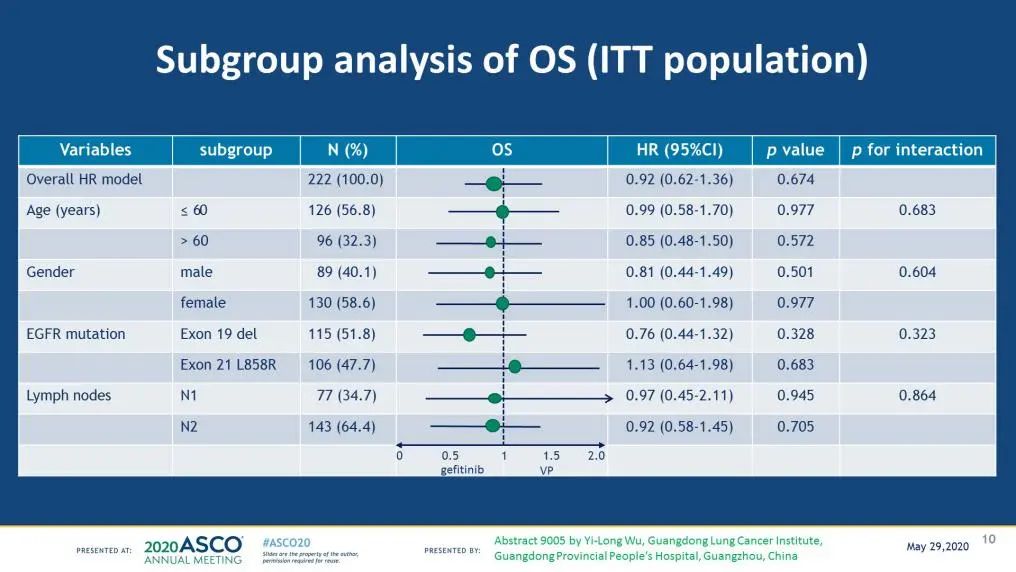
图3. ADJUVANT亚组分析(2020ASCO)
三、再添佐证
2018年发表的EVAN(NCT011683175)研究,纳入完全切除的EGFR突变的ⅢA期 NSCLC 患者,1:1随机分组,术后予厄洛替尼(51例)对比长春瑞滨+顺铂(VP)化疗(51例)。结果显示:厄洛替尼组2年DFS率为81.4%,95%CI 69.6-93.1;化疗组为44.6%,95%CI26.9-62.4;相对风险(RR)1.823,95%CI 1.194-2.784;p=0.0054[7]。
四、对前期研究的探索和分析
EGFR-TKI辅助治疗对什么样的患者更具优势?如前所述,未有效选择EGFR突变患者的BR19和RADIANT均遭遇了失败,而获得成功的ADJUVANT和EVAN研究均选择EGFR突变人群。有学者针对已经发表的研究进行了进一步分析。
一篇发表于2019年的Meta分析共纳入6个随机对照试验(RCT),肿瘤分期:IB-IIIA。其中2个研究(BR19、RADIANT)为EGFR-TKI对比安慰剂,未筛选EGFR基因突变,BR19研究实际纳入EGFR突变患患者15例(吉非替尼组7例,安慰剂组8例),RADIANT实际纳入EGFR突变患患者161例(厄洛替尼组102例,安慰剂组59例);另外3个研究为EGFR-TKI对比化疗,纳入患者全部为EGFR基因突变。
共包含1901例患者(EGFR基因突变601例)的合并分析显示:EGFR突变患者EGFR-TKI辅助治疗DFS优于化疗,HR 0.42,95%CI 0.19-0.93;EGFR野生型患者EGFR-TKI辅助治疗DFS与安慰剂相似,RR为1.00,95%CI 0.62-1.60。EGFR-TKI辅助治疗,选择优势人群(EGFR基因突变)是关键[8]。
Lu在2019年发表的Meta分析,探讨了EGFR-TKI与肿瘤分期的关系。共纳入9个研究2467例质量可接受的患者,其中6个随机对照试验,3个回顾性队列研究,总体EGFR突变率为48.62%。分析显示:I期患者<50%、IIIA期>30%的亚组DFS明显改善(HR 0.46;95%CI 0.35-0.60),I期患者>50%、IIIA期<30%的亚组DFS无显著改善(HR 0.90;95%CI 0.77-1.04)。提示IIIA期患者EGFR-TKI术后辅助获益优于I期患者,EGFR-TKI在I期患者的应用一度备受争议[9]。
五、三代EGFR-TKI进军术后辅助领域
ADAURA[10]是一项全球性、随机、双盲、安慰剂对照的III期临床研究(图4),纳入完全切除后的IB-IIIA期EGFR突变的NSCLC患者,1:1随机分组,分别接受奥希替尼(339例)和安慰剂(343例)辅助治疗。基于奥希替尼突破性优势,2020年4月10日,阿斯利康官网宣布提前揭盲。
结果显示:II-IIIA期的患者,奥希替尼对比安慰剂,DFS的HR为0.17,95%CI 0.12-0.23,p<0.0001(图5)。同时,在总人群中,DFS的HR为0.21,95%CI 0.16-0.28,p<0.0001,实现了IB-IIIA期全线获益(图6)。
ADAURA的公布,将EGFR-TKI术后辅助的可能获益人群进一步扩大,也部分回答了EGFR-TKI用于IB期患者的争议。
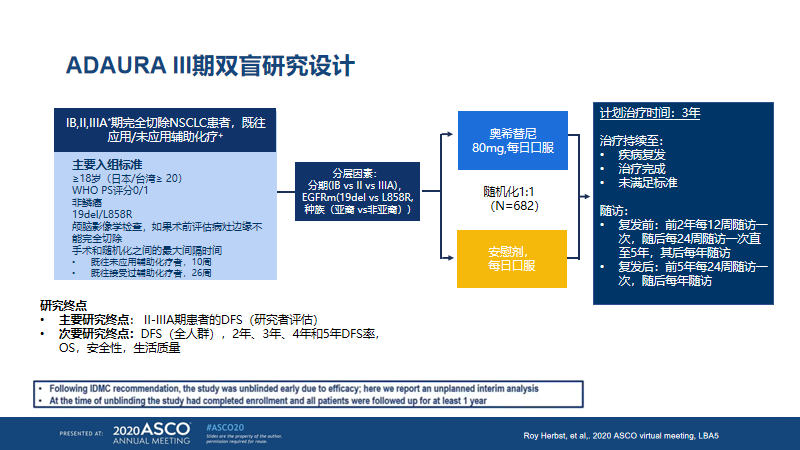
图4. ADAURA研究设计(2020ASCO)
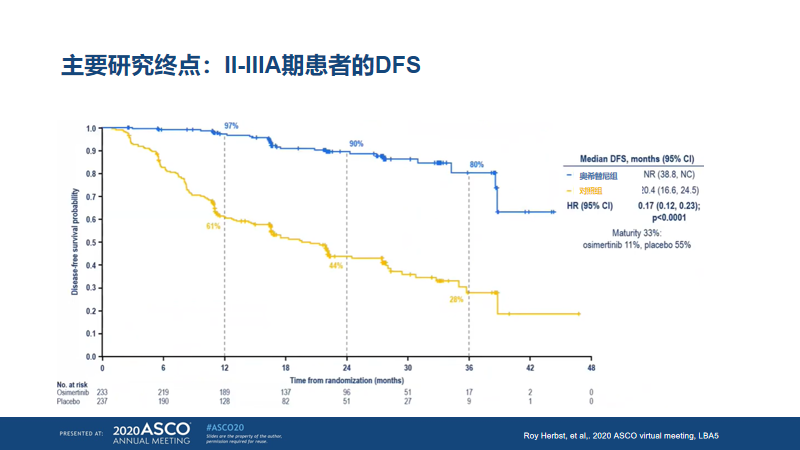
图5. ADAURA主要研究终点(2020ASCO)
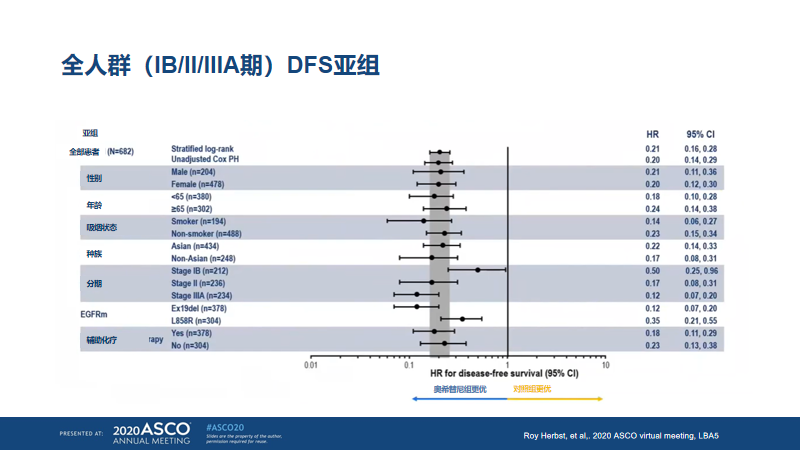
图6. ADAURA全人群亚组分析(2020ASCO)
六、思考与问题
1关于联合治疗
两个小样本研究探索了化疗联合EGFR-TKI辅助治疗模式。Feng等对IB-IIIA期EGFR基因突变的术后NSCLC患者,1:1随机对照,采用含铂双药化疗联合埃克替尼(21例),对比含铂双药辅助化疗(20例)。结果显示:化疗加埃克替尼组和单纯化疗组的12个月DFS率分别为100%和88.9%(p=0.122),18个月DFS率分别为95.2%和83.3% (p=0.225),24个月DFS率分别为90.5%和66.7%(p=0.066)。化疗加埃克替尼组与单纯化疗组的DFS差异无统计学意义[11]。
Li进行的II期研究纳入完全切除的NSCLC者60例,IIIA-N2、EGFR突变(19del或L858R),1:1随机分配,分别接受单独化疗(培美曲塞+卡铂,30例)和化疗(培美曲塞+卡铂)联合吉非替尼(30例)。结果显示:接受化疗联合吉非替尼治疗的患者的DFS明显长于单独接受化疗的患者:39.8个月 vs 27.0个月,HR为0.37;95%CI 0.16-0.85;p=0.014[12]。
不仅如此,ADAURA[8]研究的全人群DFS亚组显示:既往接受过辅助化疗的患者(378例),DFS的HR为0.18;95%CI 0.11-0.29;既往未接受过辅助化疗的患者(304例),DFS的HR为0.23;95%CI 0.13-0.38(图6)。提示既往接受过辅助化疗的患者更有可能从奥希替尼治疗中得到DFS获益。以上结果提示,对于某些特定高危人群,EGFR-TKI联合化疗的辅助治疗方式可能取得更好的效果。
2关于治疗时间
现有的研究设计多采用2年辅助治疗时间,ADAURA研究采用了3年。目前尚无循证医学证据提供最佳的用药时间。ADJUVANT事后分析显示:吉非替尼治疗≥18个月与治疗时间<18个月的患者,中位OS分别为NR(64.0-NC)和35.7个月(25.7-NC),p<0.001,差异有统计学意义[6]。
在II期单臂SELECT研究中,100例术后NSCLC患者接受厄洛替尼治疗。中位随访5.2年,共40例患者复发,其中4例在EGFR-TKI治疗过程中复发,36例在停用EGFR-TKI后复发,停药至复发的中位时间为25.4个月(0-79个月)。值得注意的是,复发患者接受EGFR-TKI治疗的时间明显短于未复发者(Wilcoxon rank sum p=0.027)[13]。
另外也有分析认为,BR19研究最初设计的服药时间为2年,由于研究提前结束,实际给药时间很短(仅约4.8个月),可能是BR19研究失败的因素之一[3]。
ADAURA研究中,奥希替尼中位持续暴露时间达22.3个月(0-43),其DFS的明显获益,或许也与其较长的药物治疗时间有关。因此,有学者认为EGFR-TKI术后辅助治疗时间可以延长。三代药物高效低毒的的特点,可以最大限度减少因为疾病进展、毒性不耐受等情况导致的停药,是EGFR-TKI术后辅助治疗的趋势。
具有不同期别/淋巴结转移数量/合并基因突变等不同临床特征的患者,术后复发转移的风险不同,其辅助靶向治疗的时长是否应该有所区别呢?这个问题还需要相应的临床研究支持。
3关于复发模式
ADJUVANT研究团队对患者进行了长期随访(中位随访36.5个月),共124例疾病进展,其中吉非替尼组58例肿瘤进展,7例在进展前死亡;VP化疗组56例进展,3例在进展前死亡。共114例肿瘤进展的患者被纳入事后分析,吉非替尼组有2例复发部位没有详细记录,在估计复发部位时被忽略不计。
如图7显示:两组的局部复发率分别为3.4%和2.8%;远处转移部位不尽相同,吉非替尼组最常见的首次远转部位为中枢神经系统,占27.4%,VP辅助化疗组占24.1%(P=0.611);VP辅助化疗组以颅外转移为初次复发部位的较多,占36.8%,吉非替尼组为22.6%(p=0.031)[14]。
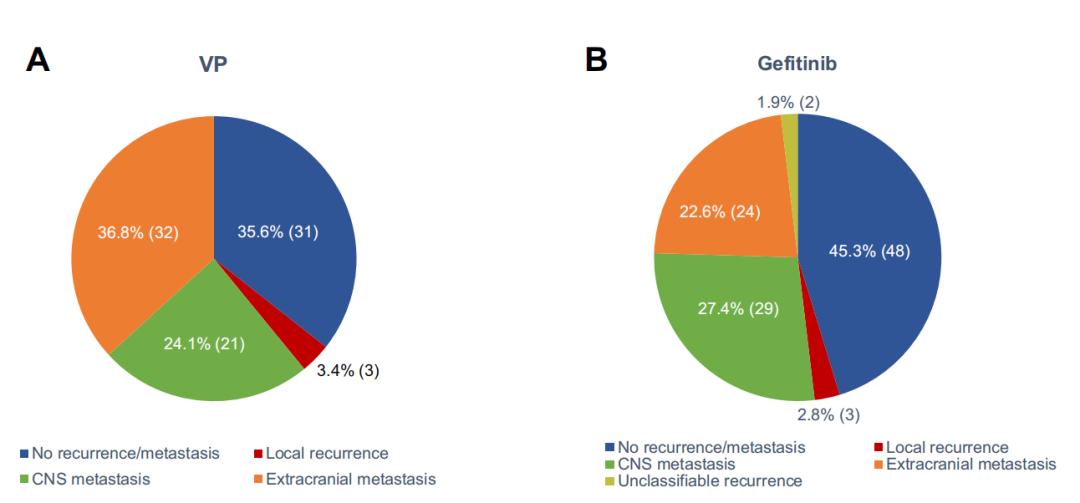
图7:ADJUVANT肿瘤进展方式
综上所述,EGFR-TKI在EGFR基因突变NSCLC术后辅助治疗领域已经占据了一席之地,然而,还有很多未解决的问题,需要进行进一步的临床研究来阐明。
参考文献
[1] Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016 Jan;11(1):39-51.
[2] Pignon JP, Tribodet H, Scagliotti GV,et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE collaborative group, J. Clin. Oncol. 26 (21) (2008) 3552–3559.
[3] Goss GD, O'Callaghan C, Lorimer I, et al. Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR19 study. J Clin Oncol. 2013 Sep 20;31(27):3320-6.
[%1] Kelly K, Altorki NK, Eberhardt WE et al, Adjuvant erlotinib versus placebo in patients with stage IB-IIIA nonsmall-Cell lung Cancer (RADIANT): a randomized, double-blind, phase III trial, J. Clin. Oncol. 33 (34) (2015) 4007–4014.
[%1] ZHONG WZ, WANG Q, MAO WM, et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage Ⅱ-ⅢA(N1-N2)EGFR-mutant NSCLC(ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study. Lancet Oncol, 2018, 19(1): 139-148.
[6] YL Wu, et al. CTONG1104: Adjuvant gefitinib versus chemotherapy for resected N1-N2 NSCLC with EGFR mutation—Final overall survival analysis of the randomized phase III trial. 2020 ASCO. Abstract 9005.
[7] Yue D, Xu S, Wang Q, et al. Erlotinib versus vinorelbine plus cisplatin as adjuvant therapy in Chinese patients with stage IIIA EGFR mutation-positive non-small-cell lung cancer (EVAN): a randomised, open-label, phase 2 trial. Lancet Respir Med. 2018 Nov;6(11):863-873.
[8] Cheng H, Li XJ, Wang XJ, et al. A meta-analysis of adjuvant EGFR-TKIs for patients with resected non-small cell lung cancer. Lung Cancer. 2019 Nov;137:7-13.
[9] Lu D, Wang Z, Liu X, et al. Differential effects of adjuvant EGFR tyrosine kinase inhibitors in patients with different stages of non-small-cell lung cancer after radical resection: an updated meta-analysis. Cancer Manag Res. 2019 Apr 2;11:2677-2690.
[10] Roy S. Herbst, et al. Osimertinib as adjuvant therapy in patients (pts) with stage IB–IIIA EGFR mutation positive (EGFRm) NSCLC after complete tumor resection: ADAURA. 2020ASCO LBA5.
[11] Feng S, Wang Y, Cai K, et al, Randomized adjuvant chemotherapy of EGFR-mutated non-small cell lung cancer patients with or without icotinib consolidation therapy, PLoS One 10 (10) (2015) e0140794.
[12] Li N, Ou W, Ye X, et al. Pemetrexed-carboplatin adjuvant chemotherapy with or without gefitinib in resected stage IIIA-N2 non-small cell lung cancer harbouring EGFR mutations: a randomized, phase II study. Ann Surg Oncol. 2014 Jun;21(6):2091-6.
[13] Pennell NA, Neal JW, Chaft JE, et al. SELECT: A Phase II Trial of Adjuvant Erlotinib in Patients With Resected Epidermal Growth Factor Receptor-Mutant Non-Small-Cell Lung Cancer. J Clin Oncol. 2019 Jan 10;37(2):97-104.
[14] Xu ST, Xi JJ, Zhong WZ, et al. The Unique Spatial-Temporal Treatment Failure Patterns of Adjuvant Gefitinib Therapy: A Post Hoc Analysis of the ADJUVANT Trial (CTONG 1104). J Thorac Oncol. 2019 Mar;14(3):503-512.
*文章来源于 医学界肿瘤频道,版权归原作者所有,如有侵权请联系删除