2019年国际乳腺癌重量级学术活动的“收官之作”——第42届圣安东尼奥乳腺癌研讨会(SABCS)于12月10日-14日在美国盛大举行。 本次会议发布了哪些乳腺癌领域的重要研究结果,又将对乳腺癌的临床治疗带来怎样的改变?来随我一起先睹为快吧!
HER2靶向治疗
PD4-07.
曲妥珠单抗/帕妥珠单抗固定剂量复方皮下制剂治疗HER2阳性早期乳腺癌:一项III期多中心、开放性、随机双臂研究FeDeriCa的主要分析结果
背景:与曲妥珠单抗(H)+化疗(CT)相比,静脉注射帕妥珠单抗(P IV)+曲妥珠单抗(H IV)联合化疗(CT)可改善HER2阳性乳腺癌患者的结局。现研发出一种新型的皮下(SC)制剂,首次将曲妥珠单抗和帕妥珠单抗与重组人透明质酸酶结合。这种即用型固定剂量复方制剂(PH FDC)的给药方式为大腿皮下注射5-8分钟。III期HannaH研究业已明确了H SC的剂量,Ib期研究(NCT02738970)确定了P SC的剂量。本研究报告了来自FeDeriCa的首个结果,该研究在接受新辅助-辅助治疗的HER2阳性早期乳腺癌患者中,比较了这一新型SC PH FDC与H IV+P IV的药代动力学、有效性和安全性。
方法:经中心确认的HER2阳性侵袭性乳腺癌患者(肿瘤>2cm,或淋巴结阳性;II-IIIC期)以1:1的比例随机接受8个周期的H IV(负荷剂量8mg/kg,维持剂量6mg/kg)+P IV(负荷剂量840mg,维持剂量420mg)联合化疗(A组)或PH FDC(负荷剂量:P SC1200mg、H SC600mg,维持剂量均为600mg)联合化疗(同A组)(第5-8个周期,q3w)(B组)的新辅助治疗。
化疗方案是研究者选择的4个周期剂量密集型多柔比星+环磷酰胺q2w→4个周期紫杉醇qw(共计12周),或者4个周期多柔比星+环磷酰胺q3w→4个周期多西他赛q3w。术后,患者按照随机分组继续接受抗HER2治疗、完成18个周期的疗程。
研究的主要目的是观察第8周期给药前PH FDC中P的血清谷浓度(Ctrough)相较于P IV的非劣效性[几何均值比(GMR)90%置信区间(CI)下限的NI界值:≥0.8]。关键次要目的是比较第8周期给药前PH FDC中H与H IV血清谷浓度的NI、乳腺和腋窝的总体病理学完全缓解率(ypT0/is,ypN0;tpCR)以及安全性[主要心脏事件定义为心力衰竭(纽约心脏协会NYHA III+IV级)伴显著左心室射血分数(LVEF)下降、心源性死亡;次要心脏事件定义为经确认的LVEF自基线下降10%∽50%]。
结果:自2018年6月14日至2018年12月24日,在122个研究中心对500例患者进行了随机化。截至2019年7月4日,A组和B组分别有242例患者(96.0%)和234例患者(94.4%)完成了新辅助治疗。两治疗组的基线时人口统计学特征和疾病特征较为均衡。
该研究达到其主要终点:P GMR为1.22(90%CI 1.14-1.31),90%CI下限高于预设的NI界值0.8。H GMR为1.33(90%CI1.24-1.43),符合NI标准(见下表)。两组的tpCR率相当[A组59.5%(95%CI 53.2-65.6);B组59.7%(95%CI 53.3-65.8)],与其他P+H联合化疗研究的结果相似。两组包括心脏安全性在内的总体安全性相似,安全性与其他P+H联合化疗研究的结果相符。
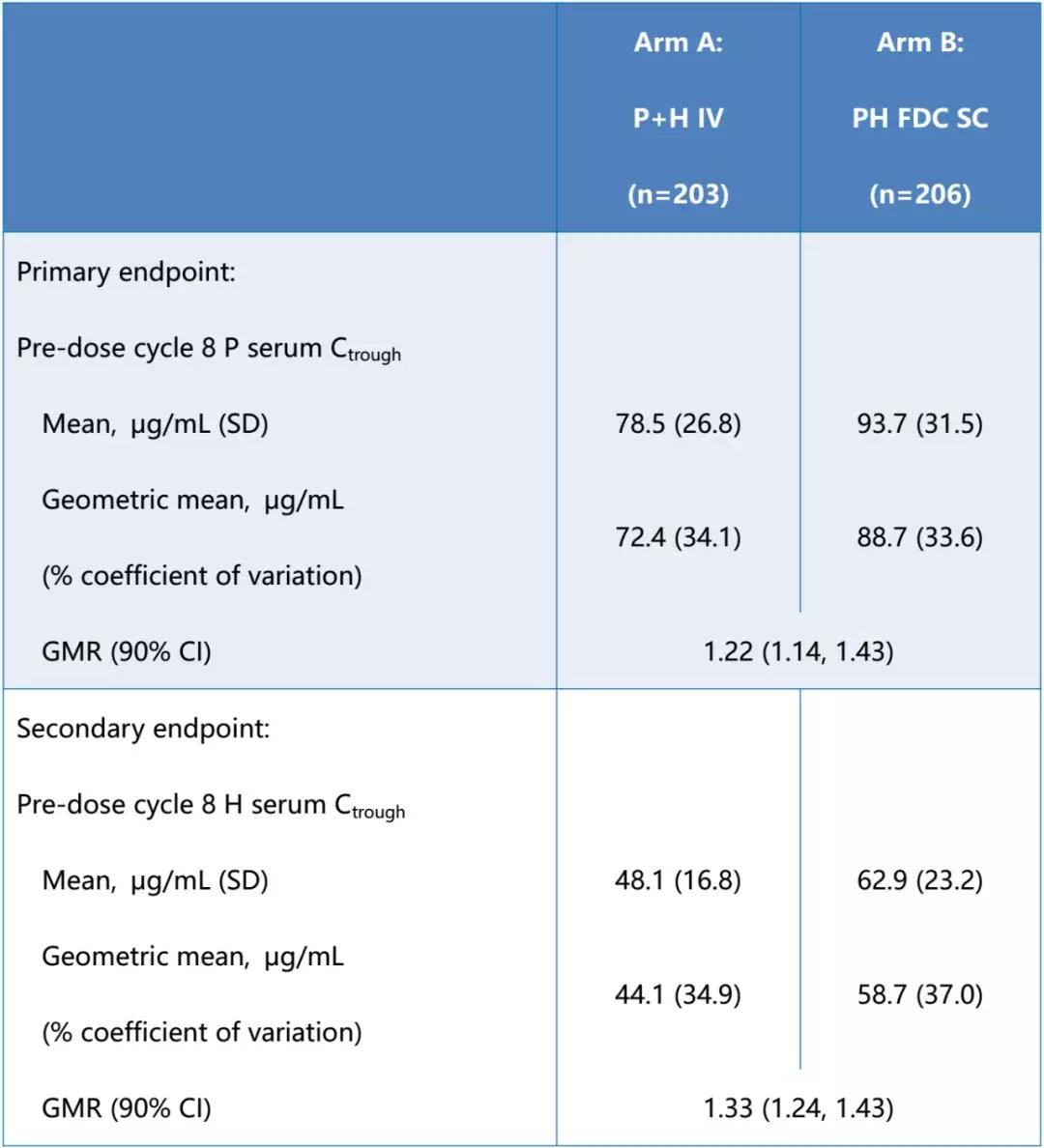
结论:该研究证实,SC PH FDC第8周期给药前的P+H血清谷浓度非劣于P IV+H IV,且有效性及安全性相当。PH FDC为HER2阳性乳腺癌患者提供了一种更快捷、更简单的P+H给药方式。
PD10-02.
ATEMPT研究(TBCRC033):T-DM1 vs. 紫杉醇+曲妥珠单抗(TH)辅助治疗患者报告结果
目的:ATEMPT试验旨在确定辅助T-DM1(每3周一次,持续1年)治疗I期HER2阳性乳腺癌的耐受性是否优于TH(紫杉醇每周一次×12周+1年曲妥珠单抗)。比较了两种治疗方法随时间的患者自评结果(PRO),包括生活质量(QOL)、特定症状和工作效率。
方法:患者随机(3:1)接受T-DM1或TH治疗,并在开始治疗后基线(第1天)、第3周、第12周以及第6、12和18个月完成PRO评估。调查包括FACT-B、患者神经毒性调查问卷(PNQ)、鹿特丹症状检查表(RSCL)、脱发患者评估、工作效率和活动障碍问卷:特定健康问题(WPAI:SHP)。
结果:469/497(94%)例患者(363例接受T-DM1治疗,106例接受TH治疗)在任意时间点完成调查,范围从基线时的100%至18个月时的79%。中位年龄为56岁(23-85)。在QOL和其他相关症状方面,各组随时间出现不同的恶化和恢复模式。
与T-DM1组相比,TH组的平均总FACT-B评分显著较低,这表明从基线期到12周时QOL较差(每个时间点p<0.001);6个月和12个月时两组的平均评分相似,18个月时TH组再次显著偏低。TH组12周时的相对于基线平均变化最大和总体FACT-B评分最低。
在接受T-DM1治疗的患者中,中度至重度感觉神经病变在12周时为8%,在18个月时达到最高水平15%。相比之下,接受TH治疗的患者中,中度至重度感觉神经病变在12周时为35%,18个月时为26%(12周时p<0.001,18个月时p=0.018)。T-DM1组的第12周脱发率为13%,TH组为77%(p<0.001)。
基线、3周和12周时TH组的平均躯体症状痛苦较大,1年时T-DM1组的平均躯体症状痛苦较大,TH组在12周时报告的症状痛苦最大。入组时两组的心理痛苦都最大,但TH组在基线、12周和18个月时显著大于T-DM1组(6个月和12个月时两组相似)。
两组对活动水平损害的影响有限。12周时TH组的就业比率最低(TH组49%,T-DM1组61%,p=0.074),3周和12周时健康治疗导致的工作时间缺失百分比、工作时损伤百分比、总体工作损伤百分比和活动损伤百分比存在显著差异,均有利于T-DM1组。
结论:接受T-DM1与TH治疗的I期HER2阳性乳腺癌患者之间的PRO存在差异。T-DM1治疗患者的生活质量较好,神经病变和脱发较少,工作效率较高,尤其是在治疗的前12周,更重要的是,差异在长期随访中是持续存在的。
P5-06-02.
HER2阳性早期乳腺癌新辅助化疗加抗HER2治疗后的病理学完全缓解(pCR)和预后
背景:达到pCR(乳房和腋窝)对早期乳腺癌患者的无事件生存期(EFS)和总生存期(OS)具有很强的预后意义(Cortazar 2014),调节治疗可改善未实现pCR的HER2阳性疾病患者的长期结局(Von Minckwitz 2019)。我们试图在含化疗加抗HER2治疗的新辅助系统性治疗后达到和未达到pCR的患者中,研究EFS和OS的预后因素。
方法:使用了来自11项HER2+早期乳腺癌新辅助治疗试验中随机分配的3710例患者的个体数据,这些试验入组的患者数量均≥100例,具有可用的pCR、EFS和OS数据,且随访时间≥3年。我们分别针对激素受体(HR)阳性和HR阴性疾病,达到pCR(pCR+; ypT0/is,ypN0)和未达到pCR(pCR-)的患者,使用分层(按试验和治疗)Cox模型评估基线临床肿瘤大小(cT)和临床淋巴结状态(cN)作为预后因素。
结果:观察组患者的治疗效果明显优于对照组,差异具有统计学意义(p<0.05)。总体中位随访时间为61.2个月。该表根据HR和pCR显示了OS(5年OS率)的风险比和5年Kaplan-Meier估计值。观察到的EFS结果相似。在大多数亚组中,包括pCR+患者中,cT(1-2 vs. 3-4)和cN(cN- vs. cN+)是OS的独立预后因素。
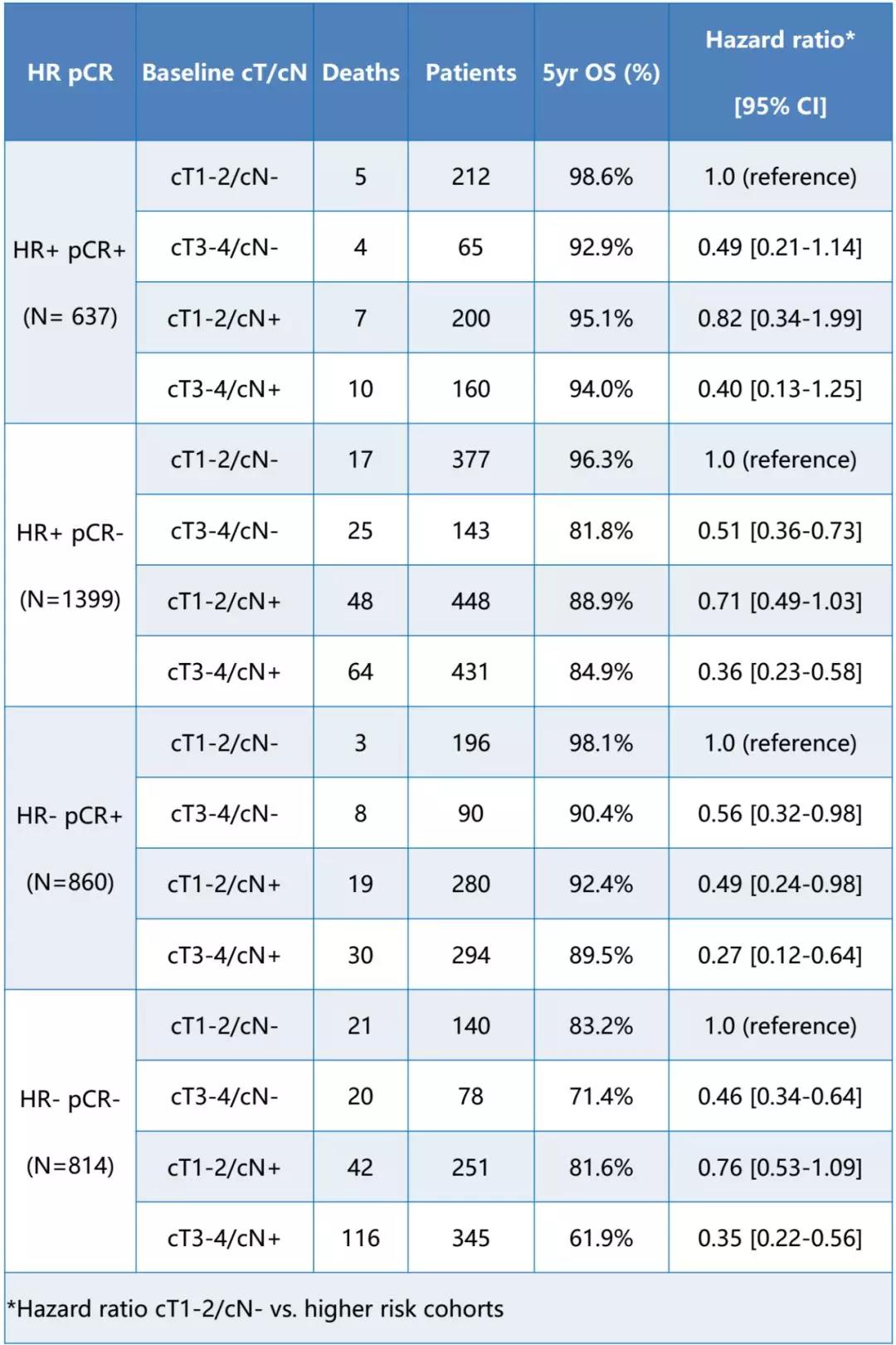
结论:这些结果证实了达到pCR的患者比没有达到pCR的患者具有更好的长期结局,而且传统的不良预后特征,如肿瘤大小和淋巴结状态,即使在pCR后仍然是重要的,没有明确的证据表明,在达到pCR的患者与未达到pCR的患者中,不利特征(cT3-4或cN+)的相对影响是不同的。
P4-10-11.
PIK3CA状态是PI3K/AKT/mTOR信号通路靶向药物治疗获益的预测因素:一项随机试验的荟萃分析
背景:已经开发出许多不同PI3K/AKT/mTOR通路的靶向药物。尽管这些通路发生突变很常见,但大多数的乳腺癌随机试验都是在未选择激活通路的患者中进行的。这里探索了PIK3CA和AKT突变在以这些信号通路为靶点的药物随机试验中的预测价值。
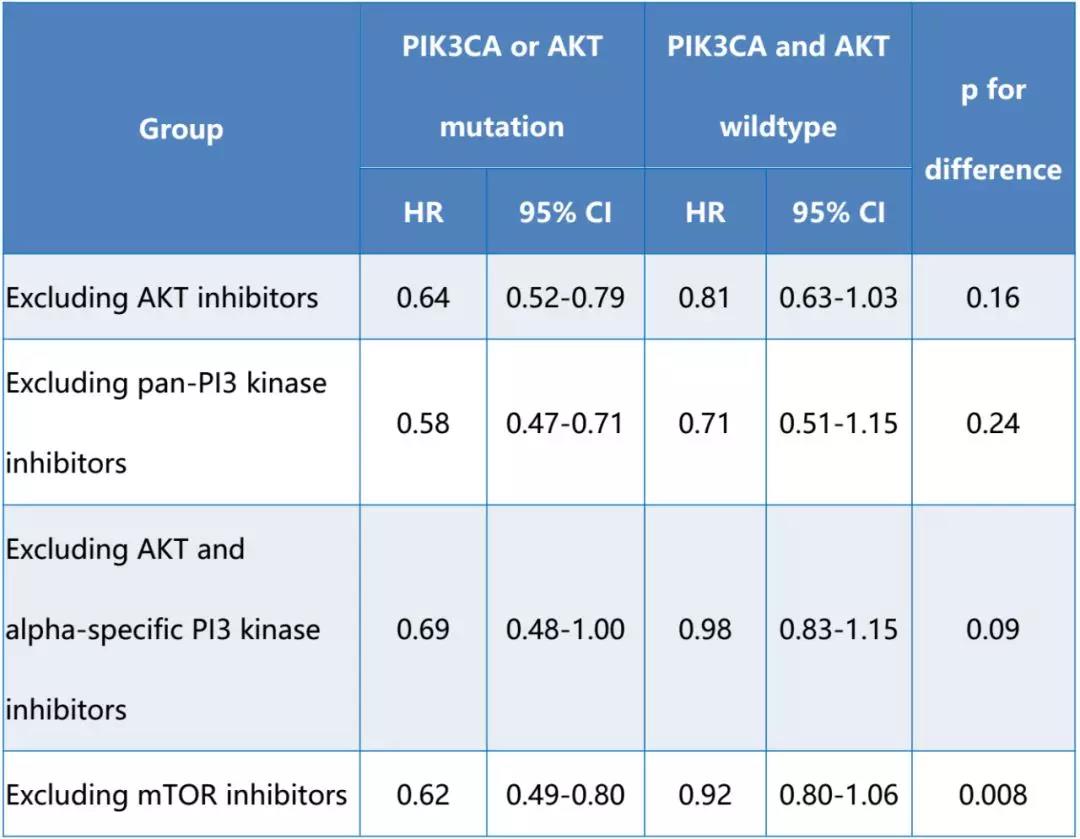
方法:我们在PubMed中检索以PI3K/AKT/mTOR信号通路为靶点的药物在转移性乳腺癌中的随机试验。合格的研究需要根据肿瘤标本或循环肿瘤DNA中PIK3CA或AKT状态的存在与否来报告疗效数据。在PIK3CA或AKT突变型和野生型组中,获取无进展生存期(PFS)的风险比(HR),并使用通用反向方差和随机效应模型进行荟萃分析。根据实验药物的作用机制进行敏感性分析。
结果:在确定的15项研究中,10项研究(包括3615例患者)符合分析条件。研究包括泛PI3k抑制剂(n=5)、α特异性PI3k抑制剂(n=1)、AKT抑制剂(n=2)和mTOR抑制剂(n=2)。大约38%的患者有PIK3CA或AKT突变。与野生型相比,PIK3CA或AKT突变患者使用PI3K/AKT/mTOR信号通路靶向药物可显著延长PFS (HR=0.61, 95%CI:0.50-0.75 vs HR=0.83, 95%CI:0.67-1.02, p=0.04)。在敏感性分析中观察到类似结果(见表)。
结论:
靶向PI3K/AKT/mTOR通路的药物在乳腺癌中的获益似乎仅发生在PIK3CA或AKT突变的患者中。这些药物未来的试验应仅在这些的患者中进行。
PD5-10.
免疫标志物对HR+/HER2+早期乳腺癌患者接受新辅助降阶T-DM1或曲妥珠单抗联合/不联合内分泌治疗的应答的影响:WSG-ADAPT-HER2+/HR+试验的子项目
背景:在高度异质性HER2+乳腺癌患者中,pCR(ypT0/is/ypN0)与改善预后相关。前瞻性、II期、三臂、新辅助治疗WSG HER2+/HR+试验(ADAPT-TP)显示,4 x T-DM1+/-ET后的pCR率约为41.0%,曲妥珠单抗+ET后的pCR率为15%。
ADAPT-TP的预设分析显示了一些对pCR有影响的生物标志物,如PIK3CA突变状态、HER2富集亚型(通过PAM50分析)、Bcl-2和最显著的免疫生物标志物(如CD8/肿瘤中心)。尤其是,在基线和/或一个周期(3w)的新辅助治疗后,较高的CD8蛋白表达水平有利于pCR。此外,CD8和PDL1动态是早期治疗应答的指标,动态应答本身有利于pCR。免疫生物标志物的影响表明,肿瘤浸润淋巴细胞(TILs)可作为降阶抗HER2治疗的预测标志物,尤其是T-DM1。
方法:对基线(TIL-0)和第3周(TIL-3)获得的组织进行半定量、3次TIL测量。在每个时间点,使用三次测量的中位数进行分析。通过免疫组化(IHC)检测两个时间点基线时的mRNA获得CD8和PD-L1表达测量值。使用logistic回归、秩相关、t和卡方统计分析半定量TIL-0 / TIL-3水平与pCR以及其他临床/病理检测之间的关联。
结果:TIL-0和TIL-3分别在355/375例和301/375例随机化患者中可用。TIL-0、TIL-3和TIL-动态(从TIL-0增加到TIL-3)与CD8和PD-L1(包括动态)和临床因素(肿瘤大小、淋巴结状态、雌激素受体(ER)和孕激素受体(PR)状态、分级、患者年龄、Ki67和绝经状态)的关联显示了一些显著的相关性:在两个时间点,TIL-0和TIL-3均与CD8(中心,而不是侵袭性边缘)和PD-L1的IHC测量值至少中等程度相关。在第2周期,TILs和CD8的相关性很强,尤其是T-DM1组(r=0.7,p<0.001)。mRNA的CD8与TIL-0中等相关。在两个时间点,临床因素与TILs之间的相关性均较弱。
这些影响pCR的已知因素提示TILs可能与pCR直接相关;使用标准化TIL-0的logistic回归分析显示,在T-DM1组中TIL-0的pCR比值约为1.4,但在整个队列中并非如此。尤其是,接受T-DM1治疗且TIL0为40%(约8%)的患者的pCR为70%,而其他患者的pCR为40%(p=0.016)。我们观察到在T-DM1治疗期间TILs的动态增加约10%。然而,这些动态增加和TIL-3均与pCR无显著相关性(与第2周期CD8蛋白表达相反)。
解释:据我们所知,这些是关于接受降阶抗HER2治疗的HR+/HER2+乳腺癌患者中TIL和TIL动态预测价值的首个前瞻性数据。在接受T-DM1治疗的患者中,非常高的TIL水平(>40%)与极好的pCR率之间70%相关。然而,与TIL相比,CD8表达和CD8动态变化对降级治疗的有效性具有更强的预测性,尽管基线和/或治疗中的TILs作为非选择性HER2+乳腺癌患者的改善预后以及提高对(双重)抗HER2治疗(联合或不联合化疗)的敏感性的标志物具有良好的数据。在得出关于TILs在早期HER2+乳腺癌患者中的临床影响的最终结论之前,需要进一步研究静态和动态免疫标志物(根据HR+和HR-/HER2+亚型)。
内分泌治疗
GS4-01.
已完成辅助AI(芳香酶抑制剂)治疗的绝经后/HR阳性乳腺癌患者继续来曲唑强化内分泌辅助治疗-NSABP B-42研究10年随访结果
背景:NSABP-B42研究是一项随机、双盲、安慰剂对照临床研究,旨在探索对于已完成5年内分泌治疗的患者,继续5年来曲唑强化内分泌辅助治疗是否可以改善无病生存(DFS)。该研究共纳入3966例绝经后I-III期HR阳性乳腺癌患者(AI起始治疗5年或他莫昔芬起始治疗≤3年序贯AI治疗共5年后无疾病复发),随机给予来曲唑2.5 mg/d或安慰剂强化内分泌辅助治疗5年。起初分析发现,5年来曲唑强化辅助治疗未改善DFS和OS,但是来曲唑强化辅助能够改善无乳腺癌间期和远端复发率。此次报道更新了10年随访结果。
方法:按照淋巴结状态,既往他莫昔芬治疗史,和基线期DEXA-T(骨密度)评分(>-2.0,≤-2.0)进行分层。主要研究终点是DFS,次要终点包括OS、BCFI(复发或者发生对侧乳腺癌事件)、骨质疏松骨折(OF)事件等 。疗效差异通过分层Log检验和Cox风险模型评估,显著性差异预设为0.05。
结果:
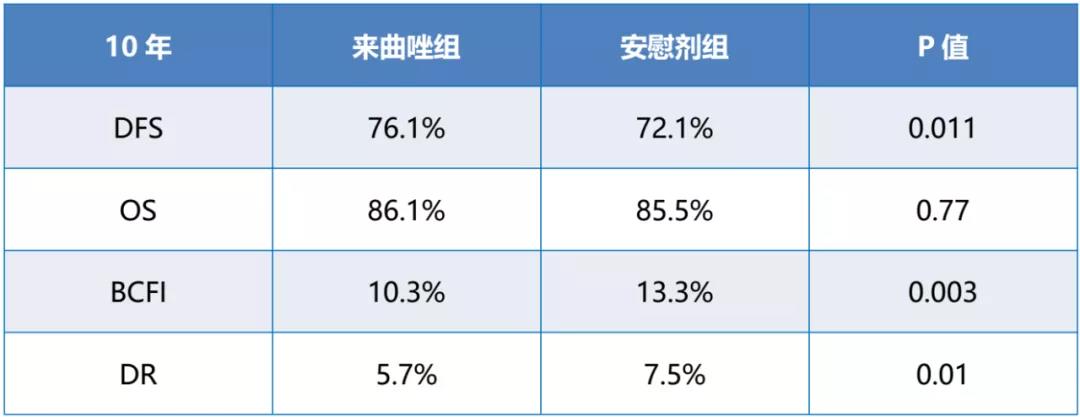
DFS:中位随访时间为9.3年。与安慰剂组比较,来曲唑显著改善DFS,使复发风险下降16%(HR=0.84; 95% CI 0.74-0.96; p=0.011)。并且,基线期骨密度评分≤2(HR=0.63; 95% CI 0.49-0.82)和>2(HR=0.93; 95% CI 0.80-1.09)的患者,来曲唑辅助治疗获益明显不同(p=0.013)。另外,与安慰剂组比较,来曲唑组使BCFI风险显著降低26%,远端复发风险显著降低29%。
OS:来曲唑组与安慰剂组无显著性差异(HR=0.97, 95% CI 0.82-1.16; p=0.77)。
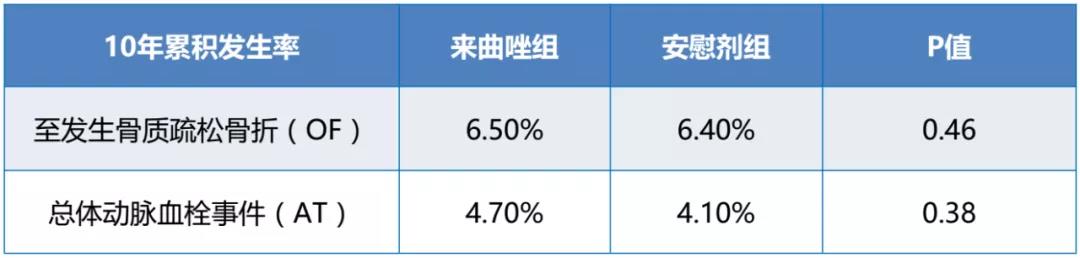
安全性:较安慰剂组,来曲唑组未显著增加至发生OF的时间和总体动脉血栓发生率。
结论:较安慰剂组,5年来曲唑强化辅助显著改善了DFS,但OS仍未达到显著性差异。与既往结果相同的是,来曲唑显著降低了BCFI和远端复发发生风险。
GS4-03.
利用CTS5评估来自TAILORx 研究的HR阳性/HER2阴性和淋巴结阴性患者的远端复发风险
背景:CTS5是一套临床病理学测算工具(淋巴结状态、肿瘤大小、分级和年龄),用来评估激素受体阳性,绝经后女性乳腺癌患者5年内分泌治疗后远端复发风险。CTS5是以ATAC(阿那曲唑、他莫昔芬,单药或联合用药)研究为训练集创建的(n=4735),并以BIG 1-98研究为验证集(n=6711)验证其有效性。此次报道旨在验证CTS5是否能够评估参与TAILORx临床研究的患者辅助治疗后5年的远端复发风险。
方法:10273例ER阳性,HER2阴性和淋巴结阴性患者被招募到TAILORx研究,根据复发风险评分和治疗方案(内分泌治疗或者化疗-内分泌治疗),随机分为4组。主要研究终点:远端复发;根据化疗情况进行分层。Cox风险模型被用来评估CTS5的作用,K-M曲线被用来评估9年远端复发风险。
结果:
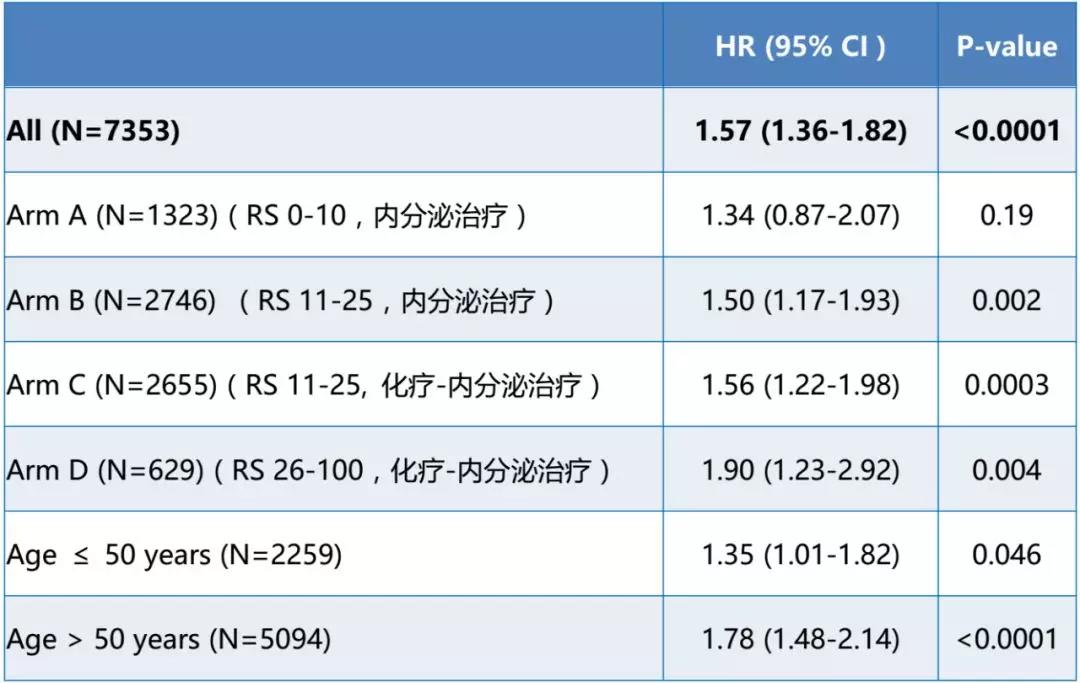
5年辅助治疗后中位随访时间是2.9年,相比较其他三组,D组(RS 26-100, 化疗-内分泌治疗)CTS5 预测效能更高(中位 CTS5 3.09 vs. 2.82, P<0.001)。总体而言,CTS5能够高度预测化疗组的晚期远端复发风险(见表)。
根据CTS5评估,5385例患者(72.9%)被分到低度风险组,1836 例患者(25.0%))被分到中度风险组,132 例患者(2.1%)被分到高度风险组。然后根据分组情况:CTS5不能评估A组(RS 0-10,内分泌治疗)晚期远端复发风险,但能够高度预测B组(RS 11-25,内分泌治疗)和C组(RS 11-25, 化疗-内分泌治疗)以及D组(RS 26-100,化疗-内分泌治疗)的晚期远端复发风险(见表)。
CTS5能够高度预测≥50岁患者的晚期远端复发(HR=1.78 (1.48-2.14), P<0.0001),但是对于<50岁患者的预测效能较小(HR=1.35 (1.01-1.82), P=0.046)。
结论:TAILORx研究中ER阳性,HER2阴性,淋巴结阴性患者RS评分为0-25(内分泌治疗)的晚期远端复发风险较低,远端复发率为3.1%(2.4-4.0),RS评分为11-100(化疗-内分泌治疗)的晚期远端复发率为3.8%(2.9-4.8)。证实CTS5能够评估来自TAILORx研究患者的晚期远端复发风险,特别是对于50岁以上患者和/或RS(11-100)视为中度或高风险的患者。但对于仅接受5年内分泌治疗的≤50的患者,CTS5对晚期远端复发的预测效能较差,因此,将CTS5应用于更年轻的患者之前,需进一步探索和评估。
参考文献
[1]https://www.abstractsonline.com/pp8/#!/7946/presentation/1977
[2]https://www.abstractsonline.com/pp8/#!/7946/presentation/1943
[3]https://www.abstractsonline.com/pp8/#!/7946/presentation/1420
[4]https://www.abstractsonline.com/pp8/#!/7946/presentation/1233
[5]https://www.abstractsonline.com/pp8/#!/7946/presentation/1989
[6]https://www.abstractsonline.com/pp8/#!/7946/presentation/1916
[7]https://www.abstractsonline.com/pp8/#!/7946/presentation/1918
*文章来源于 医学界肿瘤频道,版权归原作者所有,如有侵权请联系删除