本文原载于《国际呼吸杂志》2019年第4期
本文作者:张璐洁 李斌 李瑞娟 丁翠敏
近年来,肿瘤的免疫治疗备受瞩目,其中最成功的治疗方法之一当属免疫检查点抑制剂(immune checkpoint inhibitors,ICPi)。目前研究主要针对细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4),程序性死亡受体1(programmed death receptor-1,PD-1)/程序性死亡配体1这2个免疫检查点通路。抗CTLA-4单抗Ipilimumab,抗PD-1单抗Nivolumab,Pembrolizumab以及最近批准的抗程序性死亡配体-1单抗Atezolizumab,Avelumab和Durvalumab已由美国FDA批准用于黑色素瘤、非小细胞肺癌、肾细胞癌、尿路上皮癌、头颈部鳞癌等恶性肿瘤的治疗[1]。
ICPi与传统化疗及靶向药物的作用机制不同。在正常情况下,免疫检查点可以通过调节自身免疫反应的强度来维持免疫耐受,肿瘤细胞利用这种机制,抑制免疫细胞,从人体免疫系统中逃逸。ICPi可解除这种抑制作用,使免疫细胞重新激活工作,从而杀伤肿瘤细胞。而传统的化疗以及靶向治疗则通过快速分解肿瘤细胞和正常细胞、特定的靶向分子来抑制肿瘤生长。因此,不同的治疗方式,其不良反应机制也是不同的。对于免疫相关不良反应(immune-related adverse events,irAEs)的发生机制,目前还不十分清楚,可能与免疫检查点维持免疫稳态有关。研究表明,irAEs可能与T细胞,自身抗体和炎症性细胞因子有关[2],且大多程度较轻、易于管理。下面我们对常见的以及重要器官的irAEs作一综述。
01 irAEs概述
总体而言,与传统化疗相比,irAEs通常为1~2级[3,4]。在接受单药治疗的患者中的发生率为90%,3级以上的发生率为15%~42%,且多发生在接受抗CTLA-4单抗的患者中[5]。irAEs大多发生在治疗的最初几周至几个月内,但也可能随时发生[1]。任何器官都可能受累,最常见的是皮肤和胃肠道[3]。
02 irAEs的发生率及临床表现
2.1 免疫相关性肺炎
ICPi相关性肺炎发生率较低,多个研究报道,单药治疗时发生率小于5%。在接受抗PD-1治疗时,其发生率较高为2.7%,3级以上发生率为0.8%[6]。临床表现主要是干咳和呼吸困难。此类肺炎进展十分迅速,一旦出现低氧血症,将很快导致呼吸衰竭[6]。
2.2 肝毒性
ICPi相关性肝炎较少见,总发生率为5%~10%,3级以上的发生率为1%~2%。当联合治疗时3~4级发生率显著增加达59%[7]。其临床表现多种多样,患者一般无症状,常表现为转氨酶升高,可伴/不伴胆红素轻度升高[8]。此外,还可表现为乏力、肌痛、头痛、腹痛、恶心、呕吐、精神错乱和/或黄疸[9]。
2.3 肾毒性
肾脏系统的irAEs比较罕见,在接受Pembrolizumab或Nivolumab治疗的患者中,肾功能衰竭/肾炎的发生率为1%[10]。Ipilimumab引起的肾脏相关不良反应主要为肾炎、肾功能衰竭和狼疮性肾炎[11,12,13]。
2.4 胃肠道毒性
在抗CTLA-4治疗相关的不良反应中,胃肠道irAEs是最常见和最严重的,常导致治疗中断[14]。主要表现为腹泻、恶心和呕吐,发生率分别为33%~51%、24%~35%和12%~24%[15]。另一常见的不良反应是小肠结肠炎。Marthey等[16]报道,在接受Ipilimumab治疗的患者中,7%~22%的患者出现了结肠炎,92%患者出现腹泻,其他症状还包括腹痛、便血、呕吐、发热和体质量减轻。此外,一些患者还出现了结肠炎相关的肠外表现,如关节痛、垂体炎、肾炎、心包炎等。
2.5 内分泌系统毒性
内分泌系统irAEs常常不可逆转[4],甲状腺、垂体是最易受到影响的内分泌器官[17]。
甲状腺功能紊乱一般早期就可发现,患者并无明显症状或仅有轻微症状[18]。主要表现为甲状腺功能亢进症和甲状腺功能减退症。据报道,在Ipilimumab、Nivolumab和Pembrolizumab中的发生率分别为3.8%、6.5%和7.9%,而联合治疗时的发生率为13.2%[19]。
ICPi引起的垂体炎通常发生在接受Ipilimumab治疗的年龄偏大的男性患者中[20]。最近一项Ⅲ期临床试验证实,Ipilimumab相关的垂体炎的发生率,高剂量组(10 mg/kg)是低剂量组(3 mg/kg)的2倍,分别为6.6%和3.3%[21],表明其毒性特征呈剂量依赖性。临床表现主要为全垂体功能减退或垂体前叶功能减退,伴或不伴垂体增大,而很少出现与垂体占位相关的症状[20]。最常见的症状是头痛和疲劳[22,23]。其他罕见症状包括神经精神症状(意识模糊、幻觉、记忆力减退)、视觉障碍、失眠、厌食、恶心等[24]。
2.6 皮肤毒性
在ICPi治疗所引起的不良反应中,皮肤相关的不良反应是最常见的,多见于抗CTLA-4治疗中,发生率为43%~45%,可表现为皮疹、瘙痒和白癜风。皮疹多呈网状分布,可累及四肢及躯干,伴有红斑、水肿、斑丘疹等表现[25]。在黑色素瘤患者中,皮肤相关irAEs比较特殊,常表现为白癜风,在接受抗PD-1治疗的患者中,其发生率高达11%,且与黑色素瘤患者预后良好相关[26]。此外,比较罕见的皮肤irAEs包括药物超敏反应综合征、Sweet综合征、Stevens-Johnson综合征和中毒性表皮坏死松解症等,且已有相关的致死性报道[26]。
03 诊断及鉴别诊断
在开始接受ICPi治疗前,应考虑对所有患者行治疗前评估和诊断性检查。包括询问病史,血液检查(血常规、生化全项、糖化血红蛋白、甲状腺功能、垂体功能、甲乙肝炎检查、巨细胞病毒抗体、人类免疫缺陷病毒抗原及抗体、结核检查、心肌酶、肌钙蛋白Ⅰ、B型钠尿肽)、心电图、全身皮肤黏膜检查、基线氧饱和度、肺功能检查、6分钟步行试验等[27]。
在接受ICPi治疗时出现新发呼吸系统症状的患者,应高度怀疑ICPi相关性肺炎的可能。其影像学特征为:隐源性机化性肺炎样表现、磨玻璃样变、间质性肺炎和过敏性肺炎等[28]。而免疫相关肝炎在CT上主要表现为肝脏肿大、门静脉周围水肿、肝实质体积缩小,在MRI上表现为门静脉周围在T2WI呈高信号,以及门静脉周围淋巴结增大[29,30,31]。诊断时需与病毒性肝炎、酒精性肝炎、自身免疫性肝炎等疾病相鉴别[32]。对于治疗过程中出现肾功能损害的患者,应立即停用可能引起肾损伤的一切药物,并除外泌尿系感染、梗阻以及肾前性肾损伤等病因。当患者在治疗期间出现腹泻时,应考虑到药物引起的腹泻/结肠炎或感染性结肠炎的可能。由于这些症状及影像学表现均缺乏特异性,在诊断时应仔细鉴别,必要时可穿刺活检。
04 毒性管理
目前irAEs的评估尚无定论,国内外学者均参照美国国家癌症研究所制定的常见不良反应事件评价标准(CTCAE)v4.0对ICPi的不良反应进行评估。
对于irAEs的治疗,目前也并无明确的循证医学证据,目前的专家共识基本参照临床经验治疗。对于轻度irAEs,通常给予对症支持、口服皮质类固醇激素治疗,而中重度的irAEs,则需暂停ICPi治疗,静脉应用皮质类固醇激素,根据患者临床症状酌情加用其他免疫抑制剂(如英夫利昔单抗),必要时请专科医师会诊,待患者症状好转后,皮质类固醇激素可改为口服,再缓慢逐渐减量[27]。
此外,以下几点需特别指出:由于ICPi相关性肺炎有致死性风险,对于高度怀疑或确诊的患者应立刻接受激素治疗;因英夫利昔单抗的潜在肝毒性,不推荐其用于ICPi相关性肝炎的治疗;内分泌系统irAEs比较特殊,常不可逆转,因此需要长期的激素替代治疗[1]。具体各系统不良反应毒性管理见表1、表2[1,27]。
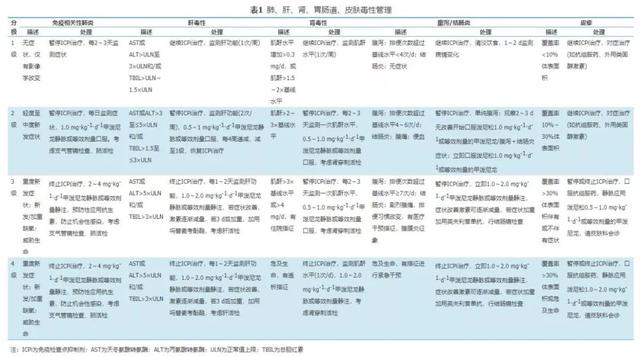
表1 肺、肝、肾、胃肠道、皮肤毒性管理

表2 内分泌系统毒性管理
05 irAEs毒性预测标志物
尽管ICPi在临床上的应用取得了显著的成效,但是这些药物的疗效在不同的肿瘤类型和个体患者之间差异很大,并非所有的患者都能获益,因此,通过生物标志物筛选潜在的获益人群,成为当前研究的重中之重。
目前研究最多的是胃肠道不良反应的预测。有报道显示,肠道微生物群的组成可能是预测结肠炎发生的潜在生物标志物。Dubin等[33]报道,拟杆菌属细菌比例增加可减少结肠炎的发生,而多胺转运通道和B族维生素生物合成遗传通路的缺失与结肠炎风险增加有关。
此外,肠道微生物群还可以预测ICPi的治疗效果。Gopalakrishnan等[34]观察到,将接受抗PD-1单抗治疗的黑色素瘤患者分为缓解组与非缓解组,2组在肠道微生物的多样性和组成方面存在显著差异。缓解组患者粪便样本中肠道细菌存在丰富的合成代谢途径,其内瘤胃菌科细菌的α多样性和相对丰度较高。免疫分析显示,有"良好"肠道菌群的患者(比如菌群具有丰富的多样性并富含瘤胃菌科细菌),可增强患者的全身免疫和抗肿瘤免疫功能,并且将缓解组患者的粪便移植给无菌小鼠时,小鼠的免疫功能也得到增强。
06 结论
相对于传统化疗,ICPi耐受性良好,大部分irAEs是可逆的,关键在于早期识别并处理。由于可累及全身各个系统,不良反应种类较多,有些症状并不典型,需要临床医师仔细鉴别。目前尚缺乏可靠的用于筛选有效人群的生物标志物,相信随着研究的深入,ICPi会给患者带来更大的获益。
(参考文献略)